Степень окисления металлов — это числовое значение, которое указывает на количество электронов, потерянных или полученных металлом при образовании ионов. Металлы из 1-3 групп главных подгрупп периодической системы характеризуются особыми особенностями степеней окисления.
Металлы первой группы, такие как литий (Li), натрий (Na) и калий (K), имеют одну внешнюю электронную оболочку и легко отдают её электрон, образуя ион с единичным положительным зарядом. Соответственно, степень окисления этих металлов равна +1. Кроме того, литий может вести себя аналогично металлам второй группы и образовывать ион с двойным положительным зарядом, поэтому его степень окисления может быть и +2.
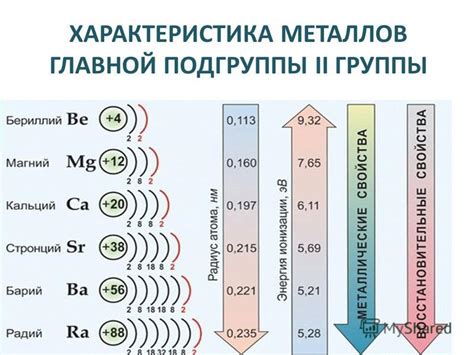
Металлы второй группы, такие как магний (Mg), кальций (Ca) и цинк (Zn), имеют две внешние электронные оболочки. Они могут отдать два электрона и образовать ионы с двойным положительным зарядом. Следовательно, степени окисления этих металлов равны +2.
Металлы третьей группы, такие как алюминий (Al), галлий (Ga) и индий (In), имеют три внешние электронные оболочки. Они могут отдать три электрона и образовать ионы с тройным положительным зарядом. Степени окисления этих металлов равны +3.
Особенности степеней окисления металлов

Степень окисления металлов связана с тем, как металл вступает в химическую реакцию и передает электроны. Она определяет, сколько электронов может металл отдать или принять при образовании ионов. В главных подгруппах 1-3 групп периодической системы степени окисления металлов имеют свои особенности.
Металлы первой группы (литий, натрий, калий и др.) обладают степенью окисления +1. Это происходит потому, что эти металлы имеют всего один электрон в своей внешней оболочке, которое они готовы отдать при реакции. Металлы второй группы (магний, цинк, кальций и др.) имеют степень окисления +2, так как они готовы отдать два электрона при вступлении в реакцию.
В отличие от первых двух групп, металлы третьей группы (бор, галлий, алюминий и др.) имеют переменную степень окисления. Она может составлять +3 или +1 в разных соединениях. Например, бор может иметь степень окисления +3 в соединениях с кислородом, но +1 в соединениях с галогенами. Галлий обычно имеет степень окисления +3, но может иметь и +1 в особых случаях.
Таким образом, степень окисления металлов 1-3 групп главных подгрупп имеет свои особенности. Металлы первой группы имеют степень окисления +1, второй группы - +2, а металлы третьей группы обладают переменной степенью окисления. Это важно учитывать при изучении химических реакций и свойств этих металлов.
Металлы 1 группы

Металлы 1 группы главных подгрупп периодической таблицы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к щелочным металлам и имеют свойства химических элементов с большей активностью.
Металлы 1 группы обладают низкой плотностью, мягкостью и низкой температурой плавления. Они хорошо проводят тепло и электричество, и образуют легко ионизируемые положительные ионы, снабженные одним электроном в внешней электронной оболочке.
Металлы 1 группы имеют одно валентное электронное наружу, что делает их очень активными химическими элементами. Они легко реагируют с водой, воздухом и другими веществами, образуя растворимые щелочные гидроксиды и газообразный водород.
Металлы 1 группы широко используются в промышленности. Например, литий применяется в производстве легких конструкций, батарей и лекарств. Натрий используется в пищевой промышленности и для производства стекла. Калий используется в производстве удобрений и растворов для полива растений.
Металлы 2 группы
Металлы 2 группы главных подгрупп (второй период) характеризуются наличием двух электронов вs-подобной внешней оболочке. Это повышает их химическую активность.
Основной ион металла в составе оксида, обычно имеет степень окисления +2. Однако, некоторые металлы 2 группы могут образовывать соединения с разными степенями окисления. Например, цинк (Zn) может образовывать соединения с +2 и +1 степенями окисления, подобно металлам первой группы.
Металлы 2 группы обладают высокой реакционной способностью и активностью в реакциях с водой и кислотами. Они способны образовывать соли и гидроксиды, которые часто имеют характерный окрас.
Некоторые представители металлов 2 группы, такие как магний (Mg) и алюминий (Al), имеют широкое промышленное применение. Магний используется в производстве легких сплавов, алюминий — в строительстве и авиапромышленности.
Восстановительные свойства металлов 2 группы также находят применение в различных процессах. Например, цинк используется в гальваническом покрытии для защиты металлических изделий от коррозии.
Металлы 3 группы
Металлы 3 группы - это элементы химической системы, которые относятся к III главной подгруппе периодической таблицы. Они обладают несколькими особенностями в своей химической активности и степенях окисления.
Одной из особенностей металлов 3 группы является наличие двух возможных степеней окисления. В своих соединениях они могут образовывать ионы с зарядом +2 и +3. Например, алюминий (Al) может образовывать ион Al3+, а галлий (Ga) – ион Ga3+.
Металлы 3 группы обладают высокой химической активностью и способностью к образованию соединений с различными элементами. Они являются хорошими окислителями и могут вступать в реакции с неметаллами, образуя соли или оксиды.
В результате химических реакций металлы 3 группы могут образовывать разнообразные соединения, такие как гидроксиды, сульфаты, хлориды и другие. Например, алюминий может образовывать гидроксид Al(OH)3, а индий (In) – хлорид InCl3.
Металлы 3 группы также обладают высокой электропроводностью и теплопроводностью, что делает их важными материалами для различных отраслей промышленности, таких как электротехника, авиация, строительство и другие.
Главные подгруппы металлов

В периодической системе химических элементов металлы разделены на несколько главных подгрупп. Главная подгруппа элементов - это группа элементов, находящихся в одной колонке периодической системы.
В первой главной подгруппе находится группа металлов 1-й группы, которая включает в себя элементы с такими степенями окисления, как +1. Элементы этой группы, например, литий (Li), натрий (Na) и калий (K), образуют однозарядные положительные ионы. Они обладают хорошей проводимостью электричества и тепла.
Во второй главной подгруппе находится группа металлов 2-й группы, которая включает в себя элементы с такими степенями окисления, как +2. Элементы этой группы, такие как магний (Mg), кальций (Ca) и цинк (Zn), образуют двухзарядные положительные ионы. Они также обладают хорошей проводимостью электричества и тепла, но имеют более высокую плотность и температуру плавления.
Третья главная подгруппа включает в себя группу металлов 3-й группы, которые могут иметь несколько степеней окисления, включая +2 и +3. Элементы этой группы, такие как алюминий (Al), галлий (Ga) и индий (In), имеют большую прочность и хорошую обрабатываемость. Они широко применяются в различных отраслях промышленности и производстве.
Вопрос-ответ

Какие металлы относятся к 1 группе главных подгрупп?
К 1 группе главных подгрупп относятся щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие особенности характеризуют степени окисления металлов 1-3 групп главных подгрупп?
У металлов 1 группы главных подгрупп степень окисления всегда равна +1, тогда как у металлов 2 группы главных подгрупп она равна +2. У металлов 3 группы главных подгрупп степень окисления может быть разной и зависит от конкретного соединения.
