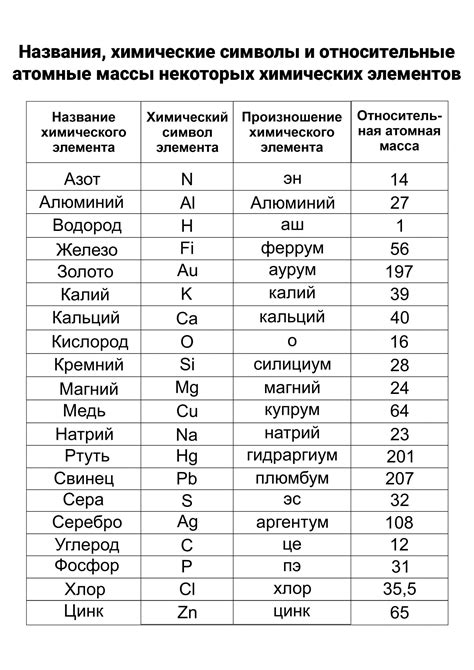
Металлы являются важным классом элементов химической таблицы, которые обладают рядом особых свойств и взаимодействуют между собой. Особенности металлов определяются их свойствами проводимости тепла и электричества, гибкостью, блеском и др. Элементы, относящиеся к 1 2 3 группам периодической системы, обладают общими чертами и взаимодействуют друг с другом по особым закономерностям.
Металлы первой группы - щелочные металлы, имеют хорошую проводимость тепла и электричества, низкую плотность и температуру плавления. Они также обладают высокой химической реактивностью, легко реагируют с водой и кислородом. Взаимодействие щелочных металлов с элементами второй и третьей группы приводит к образованию солей и осаждению соответствующих соединений.
Металлы второй группы - щелочноземельные металлы, обладают схожими свойствами с металлами первой группы, но они менее реактивны и образуют более стабильные соединения. Взаимодействие щелочноземельных металлов с элементами первой и третьей группы также приводит к образованию солей и соответствующих соединений.
Металлы третьей группы - металлы подземеля c благородным металлом указанного периодического стола, имеют более высокие температуры плавления, плотность и жесткость, чем предыдущие группы. Они имеют химическую активность, характерную для металлов, но менее выраженную. Элементы данной группы могут образовать соединения с другими элементами в таблице, обусловленные их химической активностью и особенными свойствами.
Атомные массы и свойства первой группы металлов
Первая группа металлов включает такие элементы, как литий, натрий, калий, рубидий и цезий. Они расположены в одной вертикальной группе периодической системы и имеют сходные свойства.
Атомные массы этих элементов постепенно увеличиваются вверх по группе: литий имеет наименьшую атомную массу, а цезий – наибольшую. Литий имеет атомную массу около 6.94 атомных единиц, в то время как цезий – около 132.91 атомных единиц.
Свойства первой группы металлов определяются их электрохимической активностью и способностью образовывать ион положительного заряда (катион) при химических реакциях. Элементы этой группы обладают низкой электроотрицательностью и хорошо реагируют с различными веществами.
Первая группа металлов хорошо растворяется в воде, образуя щелочные растворы, и они имеют способность высвобождать водород при реакции с кислородом. Кроме того, металлы этой группы обладают высокой теплопроводностью и электропроводностью, что делает их ценными материалами для использования в различных отраслях промышленности.
Самый известный и широко используемый элемент первой группы металлов – натрий. Он широко применяется в пищевой промышленности, металлообработке, производстве щелочей и многих других отраслях. Все элементы первой группы имеют важное значение как основные элементы для функционирования организмов и биологических процессов.
| Название | Атомная масса (ат.ед.) |
|---|---|
| Литий | 6.94 |
| Натрий | 22.99 |
| Калий | 39.10 |
| Рубидий | 85.47 |
| Цезий | 132.91 |
Химические свойства первой группы металлов
Первая группа металлов включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Элементы этой группы обладают сходными химическими свойствами и обусловлены общей структурой электронных оболочек атомов.
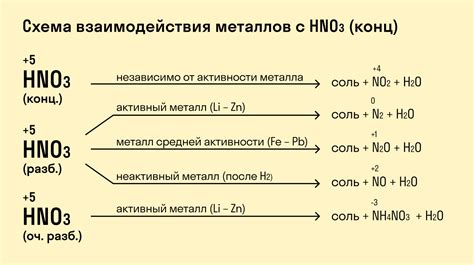
Реакции с водой: Металлы первой группы очень реактивны по отношению к воде. Они выделяются водород и образуют щелочные оксиды или гидроксиды. Реакция металлов первой группы с водой протекает очень интенсивно, с выделением значительного количества тепла.
Реакция с кислородом: Первая группа металлов реагирует с кислородом, образуя оксиды металлов. Реакция происходит через образование пассивной пленки оксида на поверхности металла, которая защищает его от дальнейшего окисления.
Взаимодействие с неметаллами: Металлы первой группы активно взаимодействуют с неметаллами. Например, они быстро реагируют с галогенами (фтором, хлором, бромом, йодом), образуя соли соответствующих кислот.
Реакции с кислотами: Многие металлы первой группы, включая литий, натрий и калий, реагируют с кислотами, образуя соли и выделяя водород. Эта реакция позволяет использовать металлы первой группы для нейтрализации кислотных растворов.
| Металл | Реакция с водой | Взаимодействие с неметаллами | Реакции с кислотами |
|---|---|---|---|
| Литий (Li) | Выделяется водород и образуется гидроксид лития | Реагирует с галогенами и образует соли | Реагирует с кислотами и образует соли и водород |
| Натрий (Na) | Выделяется водород и образуется гидроксид натрия | Реагирует с галогенами и образует соли | Реагирует с кислотами и образует соли и водород |
| Калий (K) | Выделяется водород и образуется гидроксид калия | Реагирует с галогенами и образует соли | Реагирует с кислотами и образует соли и водород |
| Рубидий (Rb) | Выделяется водород и образуется гидроксид рубидия | Реагирует с галогенами и образует соли | Реагирует с кислотами и образует соли и водород |
| Цезий (Cs) | Выделяется водород и образуется гидроксид цезия | Реагирует с галогенами и образует соли | Реагирует с кислотами и образует соли и водород |
| Франций (Fr) | Выделяется водород и образуется гидроксид франция | Реагирует с галогенами и образует соли | Реагирует с кислотами и образует соли и водород |
Металлы второй группы и их характеристики

Вторая группа периодической системы химических элементов состоит из шести металлов: бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra). Все эти металлы обладают общей характеристикой - они обладают двухвалентным положительным ионом. Это значит, что эти элементы образуют соединения, в которых их атомы отдают два электрона.
Бериллий является самым легким металлом из этой группы. Он обладает высокой прочностью и жаростойкостью, поэтому используется в производстве специальных сплавов, например, для изготовления легких и прочных летательных аппаратов. Бериллий также имеет свойство отражать рентгеновские лучи, поэтому используется в аппаратуре рентгеновских исследований.
Магний является легкометаллом с серебристо-белым оттенком. Он является одним из наиболее распространенных металлов в земной коре и используется для производства различных сплавов, включая алюминиево-магниевые сплавы, которые отличаются легкостью и прочностью. Магний также используется в производстве огнетушителей, осветительных приборов и в виде активной компоненты в многих фармацевтических препаратах.
Кальций, стронций, барий и радий являются щелочноземельными металлами и обладают множеством общих свойств. Они обладают мягкостью, серебристо-белым оттенком и низкой плотностью. Кальций является одним из наиболее распространенных элементов в земной коре и является необходимым элементом для жизни растений и животных. Стронций и барий встречаются в природе в виде соединений и используются в производстве стекол, электроники и пиротехники. Радий является редким и радиоактивным элементом, который используется в научных исследованиях и в медицине для лечения злокачественных опухолей.
Особенности атомных и физических свойств металлов третьей группы

Металлы третьей группы, такие как алюминий (Al), галлий (Ga) и индий (In), обладают рядом уникальных атомных и физических свойств.
Первое особенное свойство металлов третьей группы - это низкая плотность. Несмотря на то, что они являются металлами, они отличаются от большинства других металлов более легкой массой и нижней плотностью. Например, алюминий имеет плотность всего около 2,7 г/см³, в то время как железо имеет плотность около 7,9 г/см³.
Второе особенное свойство металлов третьей группы - их низкая температура плавления. В отличие от многих других металлов, алюминий, галлий и индий плавятся при относительно низкой температуре. Например, алюминий плавится при температуре около 660°C, что делает его одним из самых низкоплавких металлов.
Третье особенное свойство металлов третьей группы - химическая реакционность. Эти металлы обладают высокой химической активностью и легко вступают в реакцию с другими элементами. Алюминий, например, образует оксидную пленку на своей поверхности, которая защищает его от дальнейшего окисления.
Важно отметить, что металлы третьей группы также имеют ряд других характеристик и свойств, которые делают их полезными в различных областях, включая промышленность, электронику и строительство.
Реакции третьей группы металлов с кислородом
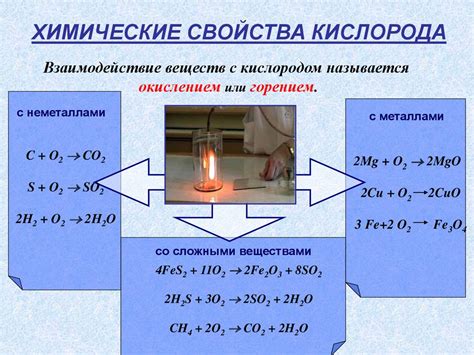
Металлы третьей группы, включающие бор, алюминий, галлий, индий и таллий, обладают различными свойствами взаимодействия с кислородом. Учитывая, что кислород является не только важным химическим элементом, но и составной частью воздуха, определение и понимание реакций данных металлов с ним является важным аспектом в химических исследованиях.
Бор, наименее реакционноспособный элемент третьей группы, реагирует с кислородом при высоких температурах. При этом, образуется оксид бора (III) — B2O3. Этот оксид обладает высокой температурой плавления, что делает его ценным материалом в промышленности.
Алюминий, наиболее широко используемый металл третьей группы, обладает свойством образовать пассивную пленку оксида. Данная пленка защищает алюминий от дальнейшего окисления. Однако, в условиях повышенной температуры и с помощью катализаторов, алюминий может реагировать с кислородом, образуя оксид алюминия (III) — Al2O3, который имеет высокую температуру плавления и применяется в производстве различных керамики и стекла.
Галлий и другие металлы третьей группы обладают низкой реакционноспособностью с кислородом. Однако, при высоких температурах они могут реагировать с кислородом и образовывать оксиды. Например, галлий, реагируя с кислородом, образует оксид галлия (III) — Ga2O3, который используется в оптоэлектронике и электронике в качестве материала для субмикронных элементов.
Индий образует также оксид индия (III) — In2O3, который используется как прозрачное и проводящее покрытие на стекле или полупроводниках. Такое покрытие обладает свойством отражать большую часть видимого света, а также обладает полупроводниковыми свойствами, что находит применение в технологии солнечных батарей.
Металлы третьей группы и их сульфаты

Металлы третьей группы периодической системы Менделеева включают бериллий, магний, кальций, стронций, барий и радий. Эти элементы обладают химическими свойствами, характерными для металлов: они являются твердыми, хорошо проводят тепло и электричество, обладают металлическим блеском и могут образовывать ионы положительного заряда.
Сульфаты металлов третьей группы являются важными химическими соединениями. Они образуются в результате реакции металлов с серной кислотой. Сульфаты металлов третьей группы обычно растворяются в воде, образуя растворы, которые имеют кислую среду. Эти соединения обладают различными свойствами и применяются в разных сферах, таких как медицина, сельское хозяйство, строительство и промышленность.
Бериллийсульфат (BeSO4) имеет белый цвет и является токсичным соединением. Он используется в производстве эмалей, стекла и керамики, а также в медицине и лаборатории в качестве катализатора и реагента.
Магнийсульфат (MgSO4) или горькая соль, является белым кристаллическим порошком. Этот сульфат широко используется в медицине как слабительное и мочегонное средство. Он также применяется в сельском хозяйстве и садоводстве для улучшения почвы и предотвращения дефицита магния у растений.
Кальцийсульфат (CaSO4) или гипс используется в строительстве как строительный материал. Он образует твердые и прочные соединения, поэтому широко применяется для производства гипсокартона, гипсовых плит, штукатурки и прочих строительных материалов.
Стронцийсульфат (SrSO4) обладает низкой растворимостью в воде и образует белые кристаллы. Это вещество используется в медицине в качестве контрастного вещества при рентгенологических исследованиях. Оно также применяется в производстве красок, пигментов и пластиков.
Барийсульфат (BaSO4) имеет низкую растворимость в воде и образует белые кристаллы. Этот сульфат используется в медицине как контрастное вещество при рентгенологических исследованиях желудочно-кишечного тракта. Он также применяется в производстве пигментов для красок, косметики и пластиков.
Радийсульфат (RaSO4) является радиоактивным соединением. Этот сульфат образуется в результате распада радия и служит источником гамма-излучения. В связи с его радиоактивными свойствами радийсульфат представляет опасность для здоровья человека и окружающей среды.
Металлы в третьей группе и их соединения с неоксидами

Металлы 3 группы периодической таблицы химических элементов включают в себя бор, алюминий, галлий, индий и таллий. Они обладают рядом особенностей и способностей, которые делают их очень интересными для исследования.
Металлы 3 группы обладают достаточно низкой электроотрицательностью, что делает их способными к образованию ионов с положительным зарядом. Они также характеризуются хорошей проводимостью электричества и тепла, что делает их востребованными материалами в различных отраслях промышленности.
Соединения металлов 3 группы с неоксидами отличаются особыми свойствами. Неоксиды, или соединения элементов с кислородом, обычно обладают кислотными свойствами. Однако, соединения металлов 3 группы с неоксидами имеют щелочные свойства. Это связано с тем, что металлы 3 группы формируют оксокатионы, в которых кислородная группа является основанием.
Например, алюминий образует неоксиды, такие как гидрооксид алюминия (Al(OH)3), которые проявляют щелочные свойства. Гидрооксид алюминия может использоваться как щелочной растворитель или вещество для нейтрализации кислых соединений.
Химические свойства третьей группы металлов

Третья группа периодической таблицы включает такие металлы, как скандий (Sc), иттрий (Y) и элементы, известные как лантаноиды или лантаниды. Эти металлы обладают рядом химических свойств, которые определяют их особенности и способности к взаимодействию с другими элементами.
Одной из самых заметных особенностей третьей группы металлов является их способность образовывать стабильные соединения с кислородом. Это свойство позволяет им образовывать окислы, которые могут иметь различные степени окисления и использоваться в различных процессах и применениях.
Еще одной характеристикой третьей группы металлов является их способность образовывать ионы различных зарядов. Например, скандий может образовывать ионы Sc3+, Sc2+ и Sc+, а иттрий может формировать ионы Y3+ и Y2+. Это делает эти металлы полезными в качестве катализаторов и в различных химических реакциях.
Лантаноиды, составляющие третью группу металлов, обладают сходными свойствами и способностью образовывать соединения с различными элементами. Они обычно образуют ионы с трехвалентным зарядом, хотя некоторые из них могут образовывать ионы с другими степенями окисления. Лантаноиды также могут образовывать стабильные комплексы с органическими соединениями и сложными ионами, что делает их важными в различных областях, включая катализ и медицину.
Взаимодействие третьей группы металлов с другими элементами зависит от их химических свойств и степеней окисления. Например, скандий и иттрий могут образовывать сплавы с другими металлами, такими как алюминий и магний, что делает их полезными в производстве различных материалов и сплавов.
Третья группа металлов имеет разнообразные химические свойства, которые определяют их способности и применения. Они обладают способностью образовывать стабильные соединения с кислородом, образовывать ионы с различными степенями окисления и взаимодействовать с другими элементами для образования сплавов и соединений.
Вопрос-ответ

Какие металлы входят в 1 группу?
К 1 группе относятся щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др. Они отличаются высокой активностью и реакционной способностью.
Какие особенности у металлов 2 группы?
Металлы 2 группы, такие как магний (Mg), кальций (Ca), цинк (Zn) и др., обладают относительно меньшей активностью по сравнению с металлами 1 группы. Они менее реакционны и обладают большей устойчивостью.
