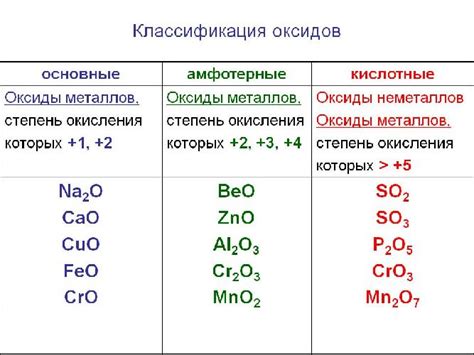
Металлы - это элементы периодической системы, обладающие хорошей тепло- и электропроводностью. Одним из важных свойств металлов является их способность образовывать кислотные оксиды, которые обладают кислотными свойствами при растворении в воде. Кислотные оксиды - это соединения, состоящие из металла и кислорода, которые реагируют с водой, образуя кислоты.
Металлы могут образовывать различные кислотные оксиды, в зависимости от степени окисления металла. Для некоторых элементов периодической системы известно несколько кислотных оксидов. Например, у железа есть два главных кислотных оксида: FeO и Fe2O3. Именно эти оксиды образуют кислоты: FeO дает гидроксид железа Fe(OH)2 и соответствующую кислоту, а Fe2O3 образует гидроксид Fe(OH)3 и соответствующую кислоту.
Свойства кислотных оксидов металлов зависят от их химического состава и структуры. Некоторые оксиды обладают высокой прочностью, твердостью и степенью растворимости в воде, что делает их ценными материалами в промышленности. Другие оксиды могут образовывать кислоты с различной степенью кислотности, что позволяет использовать их в качестве катализаторов для различных химических реакций.
Металлы и их кислотные оксиды
Металлы – это элементы химической системы, обладающие высокой теплопроводностью, электропроводностью и металлическим блеском. Каждый металл также имеет свой набор химических свойств, включая реакцию с кислотами и образование соответствующих оксидов.
Металлы могут образовывать различные типы оксидов, в том числе кислотные оксиды. Кислотные оксиды - это соединения металлов с кислородом, которые образуют кислоты при реакции с водой.
Примеры кислотных оксидов могут быть найдены в широком спектре металлов. Например, оксид серы (IV) (SO2) образуется в результате реакции серы с кислородом и является кислотным оксидом серы.
Кислотные оксиды металлов имеют свои уникальные свойства. Их растворение в воде приводит к образованию кислот, которые обычно обладают кислым вкусом, способностью к адсорбции и реакции с основаниями.
Важно отметить, что не все металлы образуют кислотные оксиды. Например, щелочные металлы, такие как натрий и калий, образуют основные оксиды при реакции с кислородом. Другие металлы, такие как алюминий и железо, могут образовывать как кислотные, так и основные оксиды в зависимости от условий реакции.
В заключение, металлы и их кислотные оксиды являются важной частью химии и науки в целом. Различные свойства и реактивность кислотных оксидов металлов делают их полезными во многих областях, включая промышленность, фармакологию и электронику.
Определение металлов

Металлы - это химические элементы, которые характеризуются высокой электропроводностью, металлическим блеском и способностью образовывать ионы положительного заряда – катионы. Они обладают высокой пластичностью и проводят тепло и электричество благодаря наличию свободных электронов в их валентных оболочках.
Первоначально металлы были определены как разновидности минералов, которые имели особые физические и химические свойства. Однако с развитием науки и открытием большого количества новых элементов, было необходимо разработать систему классификации металлов на основе их химических свойств.
Существует несколько критериев, по которым можно определить, является ли элемент металлом. Важнейшим из них является способность образовывать положительные ионы (катионы) при вступлении в химические реакции. Также металлы характеризуются высокой теплопроводностью и химической стойкостью.
Металлы подразделяются на несколько групп в зависимости от их свойств. Например, щелочные металлы, такие как литий, натрий и калий, характеризуются низкой плотностью и низкой температурой плавления. Тяжелые металлы, такие как свинец, ртуть и золото, обладают высокой плотностью и твердостью. Переходные металлы, такие как железо, медь и цинк, находятся в середине периодической системы и имеют разнообразные свойства.
Свойства металлов

Металлы являются одной из основных категорий элементов, обладающих уникальными свойствами. Они отличаются высокой теплопроводностью и электропроводностью, что делает их важными материалами для различных промышленных отраслей. Кроме того, металлы обладают высокой пластичностью и прочностью, что позволяет им быть применяемыми в различных инженерных конструкциях.
Одно из ключевых свойств металлов - это их способность образовывать ионные соединения, в результате чего они обладают химической активностью. В реакциях с кислотами металлы образуют соли, а при реакции с кислородом они образуют оксиды. Также металлы способны образовывать сплавы, что делает их еще более полезными в различных отраслях промышленности.
Существует большое количество разных элементов, которые можно отнести к металлам. Каждый из них имеет свои уникальные свойства. Например, свинец является мягким металлом с низкой плавкой точкой и способностью образовывать сплавы с другими металлами. Золото, в свою очередь, обладает высокой плотностью и является неподверженным окислению, что делает его ценным материалом для ювелирных изделий.
Металлы также обладают специфическими физическими свойствами, такими как амфотерность – способность взаимодействовать и с кислотами, и с основаниями. Важным свойством металлов является их электроотрицательность, которая ограничивает их способность к образованию ковалентных связей и делает их более готовыми образовывать ионные соединения. Все эти свойства делают металлы важными компонентами нашей жизни и широко применяемыми материалами в нашей повседневной жизни.
Определение кислотных оксидов

Кислотные оксиды - это соединения, которые образуются, когда некоторые неметаллические элементы сочетаются с кислородом. Они обладают способностью реагировать с водой, образуя кислоты. Кислотные оксиды также известны как ангидриды кислот.
Они характеризуются тем, что образуют кислоты при сочетании с водой. Например, оксид серы (SO3) реагирует с водой, образуя серную кислоту (H2SO4).
Кислотные оксиды обладают следующими химическими свойствами: они могут образовывать кислоты, реагировать с основаниями и образовывать соли. Кислотные оксиды также имеют кислотные свойства, проявляя себя в растворах как электролиты.
Они имеют также определенные физические свойства: кислотные оксиды, как правило, являются тугоплавкими, легко окисляются и обычно обладают высокой теплопроводностью. Они могут быть газообразными, жидкими или твердыми веществами в зависимости от условий.
Известные примеры кислотных оксидов включают оксид серы (SO3), оксид азота (NO2), оксид углерода (CO2) и оксид фосфора (P2O5).
Свойства кислотных оксидов
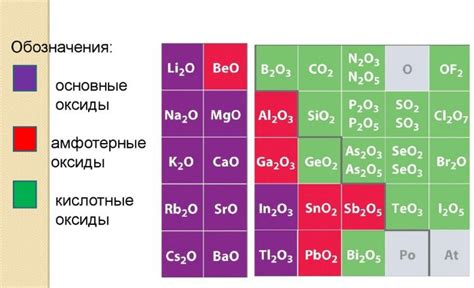
Кислотные оксиды являются соединениями металлов с кислородом, которые взаимодействуют с водой, образуя кислоты. Они обладают рядом характеристических свойств, которые делают их полезными в различных областях.
1. Кислотные свойства: Кислотные оксиды представляют собой сильные кислотообразующие соединения. Они реагируют с водой, образуя кислоты и высвобождая водород. Это свойство позволяет использовать кислотные оксиды для производства различных кислот, таких как серная, азотная и фосфорная кислоты.
2. Коррозионные свойства: Кислотные оксиды обладают высокой коррозионной активностью. Они способны разрушать металлы, вызывая их окисление и образование коррозии. Это свойство делает кислотные оксиды важными в процессах, связанных с очисткой и удалением ржавчины с металлических поверхностей.
3. Физические свойства: Кислотные оксиды обычно имеют высокую плотность и твердые формы. Некоторые из них обладают также хорошей теплопроводностью и электропроводностью. Эти свойства делают кислотные оксиды полезными в промышленных процессах, таких как производство стекла, керамики и других материалов.
4. Инертность: Некоторые кислотные оксиды обладают инертными свойствами, то есть они не реагируют с другими веществами в обычных условиях. Это свойство делает их полезными в процессах, требующих стабильности и отсутствия взаимодействия с другими веществами, например, в производстве электроники и жидкокристаллических экранов.
В целом, свойства кислотных оксидов делают их важными и полезными в различных областях промышленности, науки и технологии.
Металлы и соответствующие им кислотные оксиды
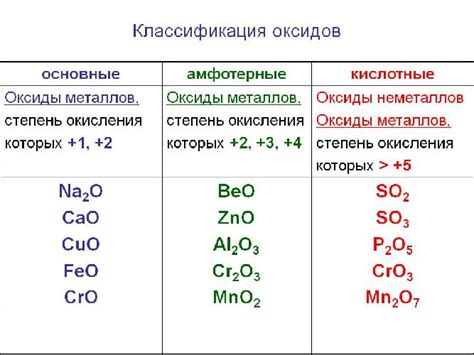
Металлы в химии – это класс элементов, которые характеризуются блестящей поверхностью, хорошей тепло- и электропроводностью, а также способностью образовывать ионы положительного заряда.
Одной из важных характеристик металлов является их способность образовывать кислотные оксиды при взаимодействии с кислородом. Кислотные оксиды металлов обладают различной химической активностью и могут образовывать кислотные растворы при взаимодействии с водой.
В периодической системе элементов металлы находятся слева от ступенчатой линии, а их кислотные оксиды легко определяются по формуле МхОу, где М – химический символ металла, х – его стехиометрическое число, а у – стехиометрическое число кислорода. Примерами таких соответствий являются пары железо(II) оксид (FeO), медь(I) оксид (Cu2O), алюминий(III) оксид (Al2O3), и многие другие.
Кислотные оксиды металлов широко применяются в различных областях, включая металлургию, электронику, катализ и строительство. Они используются в процессах производства стали, при изготовлении электронных компонентов, для синтеза химических соединений, и в качестве огнеупорных материалов.
Физические свойства металлов и их кислотных оксидов
Металлы - это химические элементы, обладающие рядом характерных физических свойств. Они обычно обладают высокой теплопроводностью и электропроводностью, что делает их полезными для использования в различных электрических и тепловых устройствах. Они также обладают высокой пластичностью и прочностью, что позволяет им быть легко формуемыми и использоваться в строительстве и производстве различных изделий.
Кроме того, металлы обычно имеют блестящую поверхность, которая связана с их способностью отражать свет. Это делает их привлекательными для использования в ювелирных изделиях и декоративных элементах. Важным свойством металлов является их плотность, которая определяет их массу в определенном объеме. Например, свинец имеет высокую плотность, в то время как алюминий имеет низкую.
Кислотные оксиды, с другой стороны, являются неорганическими соединениями, которые образуются при взаимодействии кислорода с металлами. Они обычно обладают кислотными свойствами, так как они могут реагировать с водой, образуя кислоты. Эти оксиды часто выступают в качестве непроводников электричества и тепла и могут быть использованы в качестве изоляционных материалов. Некоторые из них также обладают прочностью и твердостью, что делает их полезными для использования в строительстве и производстве различных материалов.
Как металлы, так и их кислотные оксиды обладают отличными физическими свойствами, которые делают их полезными в различных отраслях промышленности и научных исследованиях. Понимание этих свойств помогает нам использовать эти материалы более эффективно и разрабатывать новые технологии и материалы в будущем.
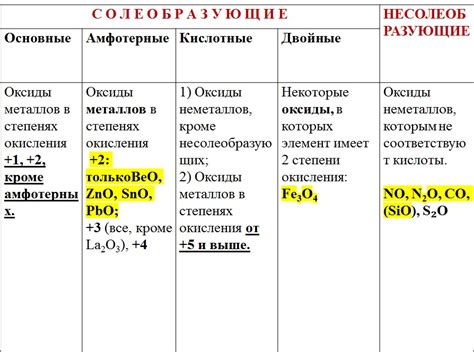
Химические свойства металлов и их кислотных оксидов
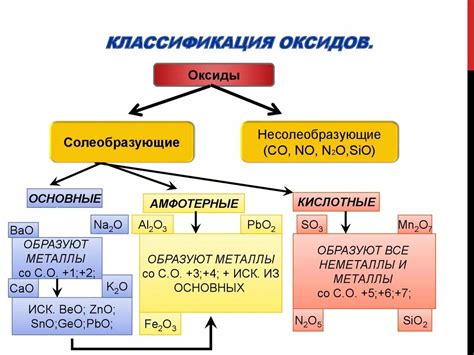
Металлы обладают рядом химических свойств, которые определяют их реакционную способность и взаимодействие с другими веществами. Одним из важных свойств металлов является способность образовывать кислотные оксиды при взаимодействии с кислородом. Кислотные оксиды представляют собой соединения, которые способны образовывать кислоты при контакте с водой.
Кислотные оксиды металлов могут быть как основными, так и амфотерными. Основные оксиды металлов образуют щелочные растворы при растворении в воде. Они реагируют с водой, образуя гидроксиды металлов и выделяя при этом тепло. Амфотерные оксиды металлов могут реагировать как с кислотами, так и с щелочами, образуя соли.
Образование кислотных оксидов металлами имеет важное промышленное значение. Например, оксид железа Fe2O3, который образуется при окислении железа воздухом, используется в качестве сырья для производства стали. Также, многие кислотные оксиды металлов используются в процессе производства керамики, стекла и различных электронных компонентов.
Химические свойства металлов и их кислотных оксидов определяют возможные реакции, в которых они могут участвовать. Это позволяет использовать металлы и их оксиды в различных областях промышленности, науки и технологий. Понимание этих свойств является важным для разработки новых материалов и технологических процессов, а также для повседневной практической работы с металлами и их соединениями.
Применение металлов и их кислотных оксидов в промышленности

Металлы и их кислотные оксиды широко используются в различных отраслях промышленности благодаря своим уникальным свойствам и химическим реакциям.
Одно из основных применений металлов в промышленности - это производство различных конструкционных материалов. Металлы, такие как железо, алюминий и медь, обладают высокой прочностью и устойчивостью к механическим нагрузкам, что делает их идеальными материалами для производства строительных конструкций, автомобилей и многих других изделий.
Кроме того, металлы и их кислотные оксиды применяются в процессах обработки поверхностей. Медь и ее оксиды используются для нанесения электропроводящего слоя на печатные платы и провода, а алюминий и его оксиды применяются в анодировании, благодаря чему поверхность алюминиевых изделий становится более прочной, коррозионно-устойчивой и эстетичной.
Еще одной важной промышленной областью, где широко применяются металлы и их кислотные оксиды, является производство электроники. Многие металлы, такие как кремний, алюминий и медь, используются в производстве полупроводниковых материалов, нужных для изготовления микрочипов, транзисторов и других электронных компонентов. Кислотные оксиды, такие как оксид алюминия и оксид кремния, используются в процессе производства электрических изоляторов и субстратов для полупроводников.
Кроме того, металлы и их кислотные оксиды находят применение в производстве красок и пигментов, катализаторов, батарей, аккумуляторов и многих других продуктов промышленности. Они играют ключевую роль в создании новых материалов с улучшенными свойствами и обеспечивают эффективность и надежность в различных отраслях промышленности.
Вопрос-ответ

Какие металлы образуют кислотные оксиды?
Многие металлы образуют кислотные оксиды. Например, медь образует оксид CuO, железо образует Fe2O3, алюминий образует Al2O3 и т.д.
Какие свойства имеют кислотные оксиды?
Кислотные оксиды обладают рядом характерных свойств. Они образуют кислоты при реакции с водой, а при реакции с основаниями образуют соли и воду. Также они обладают кислотными свойствами и реагируют с щелочами, образуя соли.
Какие соответствия между металлами и их кислотными оксидами существуют?
Существуют определенные соответствия между металлами и их кислотными оксидами. Например, кислотный оксид меди CuO образуется из меди Cu. Также оксид железа Fe2O3 образуется из железа Fe, а оксид алюминия Al2O3 образуется из алюминия Al. Эти соответствия отражают закономерности химических реакций и позволяют предсказывать образование оксидов различных металлов.
