Металлы и оксиды металлов играют важную роль в различных химических реакциях и процессах. Оксиды металлов - это химические соединения, состоящие из кислорода и одного или более металлических элементов. Когда оксид металла реагирует с водой или кислотой, его металлический элемент становится ионом металла и может образовывать различные химические соединения, такие как соли и нерастворимые основания.
Соли - это химические соединения, образованные из металлического иона и иона кислоты. Когда металл оксид реагирует с кислотой, образуются соли и вода. Например, реакция меди оксида с соляной кислотой приводит к образованию хлорида меди и воды. Соли имеют широкое применение в различных отраслях, таких как пищевая промышленность, фармацевтика и сельское хозяйство.
Нерастворимые основания - это химические соединения, которые не растворяются в воде. Они образуются при реакции металлических оксидов с водой. Амфотерные оксиды, такие как оксид алюминия и оксид железа, могут выступать как основание или кислота в реакциях с водой. Например, оксид алюминия реагирует с водой, образуя гидроксид алюминия, который является нерастворимым основанием.
Металлы оксиды металлов
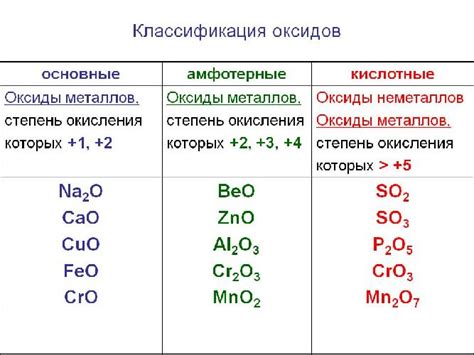
Металл оксид металла – это химическое соединение, состоящее из металла и кислорода. Оксиды металлов являются одними из основных классов неорганических соединений и широко используются в различных отраслях промышленности и науки.
Металлические оксиды имеют разные свойства и применяются в разных областях. Некоторые оксиды металлов применяются в качестве катализаторов в химической промышленности, другие используются в производстве керамики и стекла. Некоторые оксиды металлов обладают полупроводниковыми свойствами и применяются в электронике и солнечных батареях.
Оксиды металлов могут образовывать соли, которые широко используются в пищевой промышленности и медицине. Эти соли являются нерастворимыми и могут образовывать осадок в жидкостях, что может быть использовано в процессе очистки воды.
Некоторые металлы, такие как железо и алюминий, образуют различные оксиды в зависимости от условий окисления. Например, железо может образовывать два вида оксидов: FeO и Fe2O3, которые имеют разные физические и химические свойства.
Металл оксид металла: свойства и применение

Свойства металла оксида металла:
- Высокая температура плавления. Большинство оксидов металлов обладают высокой температурой плавления, что делает их отличными материалами для использования в высокотемпературных процессах, таких как плавка металлов и сплавов.
- Проводимость электричества. Многие оксиды металлов обладают высокой электрической проводимостью, что делает их полезными в электронике и электротехнике.
- Магнитные свойства. Некоторые оксиды металлов являются ферромагнетиками и обладают магнитными свойствами. Это открывает возможности для их использования в магнитных материалах и устройствах.
- Химическая устойчивость. Большинство оксидов металлов химически стабильны и не подвержены коррозии. Это делает их надежными материалами для использования в агрессивных средах.
Применение металла оксида металла:
- Керамика и стекло. Многие оксиды металлов используются в производстве керамики и стекла благодаря своим свойствам, таким как высокая температура плавления и химическая устойчивость.
- Катализаторы. Оксиды металлов часто используются в качестве катализаторов в химических реакциях для ускорения процесса и повышения эффективности.
- Электроника. Многие оксиды металлов используются в производстве электронных компонентов, таких как транзисторы и диоды, благодаря своей электрической проводимости.
- Магнитные материалы. Оксиды металлов с магнитными свойствами используются в производстве магнитных материалов, например, для создания постоянных магнитов.
Металл оксид металла является важным классом соединений, которые имеют широкий спектр свойств и применений. Они играют важную роль в различных отраслях промышленности, включая металлургию, электронику, керамику и другие. Понимание свойств и применений металла оксида металла позволяет разрабатывать новые материалы и улучшать существующие технологии.
Металл оксид металла: нерастворимое основание

Металл оксид металла представляет собой соединение металла с кислородом. Как правило, оксиды образуют сложные кристаллические структуры с высокой прочностью и плотностью.
Многие металлические оксиды обладают свойством быть нерастворимыми в воде. Такие вещества, в результате реакции с водой, могут образовывать нерастворимые основания. Нерастворимые основания могут быть использованы в различных химических процессах, в качестве катализаторов или как основа для синтеза других веществ.
Примером металла оксида, образующего нерастворимое основание, может служить оксид алюминия (Al2O3). Данный оксид обычно образует плотные и стойкие кристаллические структуры, которые слабо растворимы в воде.
В реакции с водой оксид алюминия образует гидроксид алюминия (Al(OH)3), который является нерастворимым основанием. Гидроксид алюминия может использоваться в процессах обезвоживания, очистки воды и производства алюминия.
В заключение, металл оксид металла является источником нерастворимых оснований, которые находят применение в различных химических процессах. Одним из примеров такого основания является гидроксид алюминия, получаемый при реакции оксида алюминия с водой.
Металл оксид металла: соль и ее характеристики

Металл оксид металла представляет собой соединение двух элементов - металла и кислорода. Когда металл реагирует с кислородом, образуется оксид, который может использоваться для получения различных соединений, в том числе и солей.
Соль - это нерастворимое в воде соединение, состоящее из аниона и катиона. Соли могут быть получены путем реакции оксида металла с кислотой. Примерами таких реакций являются образование хлорида натрия (NaCl) из оксида натрия (Na2O) и соляной кислоты (HCl) или образование сульфата меди (CuSO4) из оксида меди (CuO) и серной кислоты (H2SO4).
Соли имеют ряд характеристик, которые позволяют классифицировать их по различным признакам. Например, соли могут быть кислыми, основными или нейтральными в зависимости от реакции с водными растворами. Они также могут образовывать кристаллическую структуру, иметь определенную температуру плавления и кипения, а также быть растворимыми или нерастворимыми в воде.
Кроме того, соли могут обладать различными свойствами и применениями. Некоторые соли используются в пищевой промышленности в качестве консервантов или усилителей вкуса, некоторые - в медицине в качестве лекарственных препаратов. Другие соли могут использоваться в процессах огнезащитного покрытия или как катализаторы в химической промышленности.
Все эти свойства и характеристики делают соли из металл оксидов металлов важными соединениями с широким спектром применений и значимостью в различных отраслях промышленности и науки.
Вопрос-ответ

Что такое металл оксид металла?
Металл оксид металла - это химическое соединение, состоящее из одного атома металла и одной или нескольких молекул кислорода.
Какие свойства имеет металл оксид металла?
Свойства металл оксидов металлов зависят от конкретного оксида. Однако в целом они обладают высокой теплостойкостью, являются электропроводными и имеют различные степени растворимости в воде.
Как металл оксид металла может действовать как соль?
Металл оксид металла может действовать как соль в реакциях с кислотами, образуя соли и воду. Например, оксид железа (III) реагирует с соляной кислотой, образуя хлорид железа (III) и воду.
Как металл оксид металла может действовать как нерастворимое основание?
Металл оксид металла может действовать как нерастворимое основание в реакциях с кислотами, образуя гидроксид металла. Например, оксид алюминия реагирует с соляной кислотой, образуя хлорид алюминия и воду.
Возможно ли растворение металл оксидов металлов в воде?
Некоторые металл оксиды металлов могут растворяться в воде, образуя щелочные растворы. В частности, оксид натрия и оксид калия легко растворяются в воде, образуя соответствующие гидроксиды.
