Щелочные металлы – одна из основных групп элементов в периодической системе Менделеева. Они включают элементы первой группы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы отличаются наличием свободно движущихся электронов, что придает им способность проводить электрический ток. Однако, каждый из этих элементов обладает своими особенностями, которые делают их уникальными и интересными для исследования.
Одной из ярко выраженных особенностей щелочных металлов является их мягкость. Литий, натрий, калий и другие элементы этой группы легко нарезаются ножом и способны крошиться при небольшом давлении. Это связано с укладкой электронов в их электронные оболочки, что делает связь между атомами слабой и позволяет легко двигаться структуре металла.
Щелочные металлы также отличаются низкой плотностью. Калий и цезий являются двумя из самых легких металлов в периодической системе. Их низкая плотность делает их легкими и плавающими на воде. Эта особенность связана с их электронной структурой и наличием большого количества пустых электронных уровней, которые могут быть заняты электронами и образовывать связи между атомами.
Самой яркой особенностью щелочных металлов является их высокая реактивность. Элементы этой группы легко вступают в химические реакции, особенно с водой и кислородом. Они образуют гидроксиды, взрываются при контакте с водой, образуют яркие огни и горят при взаимодействии с воздухом. Это объясняется их низкой ионизацией, что позволяет легко освобождать электроны и образовывать ионы с положительным зарядом.
Особенности металлических свойств щелочных металлов
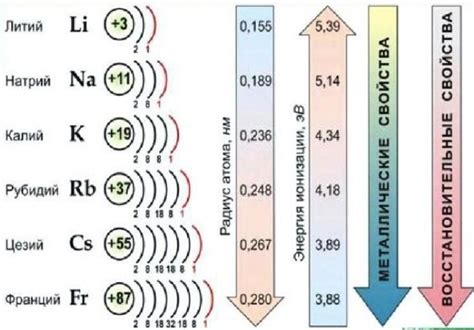
Щелочные металлы, такие как литий, натрий, калий и другие, обладают рядом выраженных особенностей своих металлических свойств.
Во-первых, щелочные металлы обладают низкой плотностью, что делает их легкими и хорошо плавающими на воде. Именно из-за этой особенности натрий и калий используются для выработки водородного газа путем реакции с водой.
Во-вторых, щелочные металлы имеют низкую температуру плавления, что делает их легко перерабатываемыми и формируемыми в различные конструкции. Например, литий широко используется в промышленности для производства аккумуляторов, благодаря своим металлическим свойствам.
Также стоит отметить, что щелочные металлы обладают высокой химической реактивностью, что проявляется в их способности быстро реагировать с водой и кислородом из воздуха. Именно из-за этой особенности их необходимо хранить под слоем масла или в инертной среде, чтобы предотвратить нежелательные химические реакции.
Наконец, щелочные металлы обладают хорошей электрической проводимостью. Их металлические свойства позволяют использовать их в различных электронных устройствах и проводящих материалах.
Таким образом, металлические свойства щелочных металлов обладают низкой плотностью, низкой температурой плавления, высокой химической реактивностью и хорошей электрической проводимостью, что делает их незаменимыми в различных отраслях промышленности и науки.
Атомная структура щелочных металлов
Щелочные металлы - это группа химических элементов, которая включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы элементов и характеризуются ярко выраженными металлическими свойствами.
Атомная структура щелочных металлов обладает рядом особенностей. Каждый атом щелочного металла имеет одну валентную электронную оболочку, в которой находится 1 электрон. Это делает эти элементы очень химически активными и способными образовывать прочные и стабильные соединения с другими элементами.
Одной из особенностей атомной структуры щелочных металлов является их малая энергия ионизации. Это означает, что для удаления электрона из валентной оболочки атома щелочного металла требуется небольшое количество энергии. Благодаря этому, щелочные металлы легко образуют положительные ионы, а их соединения обычно имеют ионную природу.
Кроме того, атомные радиусы щелочных металлов постепенно увеличиваются от лития к францию. Это объясняется тем, что с ростом атомного номера увеличивается количество электронов и протонов в атоме. Больший атомный радиус позволяет атомам щелочных металлов образовывать металлическую решетку, в которой положительно заряженные ядра притягивают слабo связанные электроны общего энергетического уровня.
Таким образом, атомная структура щелочных металлов обеспечивает им высокую реакционную способность, низкую энергию ионизации и способность формировать металлическую решетку в своих соединениях.
Высокая электропроводность щелочных металлов
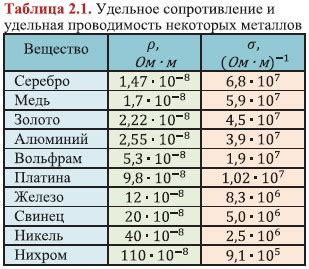
Щелочные металлы обладают высокой электропроводностью и являются одними из лучших проводников электричества. Это свойство обусловлено их особой электронной структурой и низкой энергией ионизации.
Щелочные металлы имеют один электрон во внешней оболочке, что делает их легкими отдавать этот электрон другим веществам. Это приводит к образованию положительных ионов щелочных металлов, которые легко движутся в проводнике, создавая ток.
Ионизация щелочных металлов происходит при небольшой энергии, что позволяет им легко отдавать свои электроны и стать положительно заряженными ионами. Возникающие заряды облегчают передвижение электронов вещества и обеспечивают его высокую электропроводность.
Высокая электропроводность щелочных металлов является причиной их широкого применения в различных областях. Они используются в производстве электрических проводов, элементов батарей, электролитов, электродов и других устройств связанных с электрическим током.
Благодаря своим уникальным свойствам, щелочные металлы являются важным элементом в электротехнике и сырьевой базой для создания современных электронных устройств.
Гигантская реакционная способность щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., проявляют гигантскую реакционную способность, что делает их особыми и важными элементами химической таблицы.
Эти металлы обладают свойством легко реагировать с водой, кислородом и другими элементами, что делает их высоко реакционными. Такая способность обусловлена строением атомов щелочных металлов и их электронной конфигурацией.
Вода, например, реагирует с щелочными металлами, образуя гидроксиды и выделяя водород. При этом происходит интенсивное сверкание и плавление металла. Эта реакция ярко иллюстрирует активность щелочных металлов и их способность взаимодействовать с другими веществами.
Гигантская реакционная способность щелочных металлов определяется их высокой электроотрицательностью и низкими энергиями ионизации. Такие химические свойства позволяют использовать щелочные металлы в различных отраслях промышленности и научных исследованиях. Их реакционная способность также может представлять опасность, если не соблюдаются необходимые меры предосторожности.
Свойства щелочных металлов взаимодействия с водой
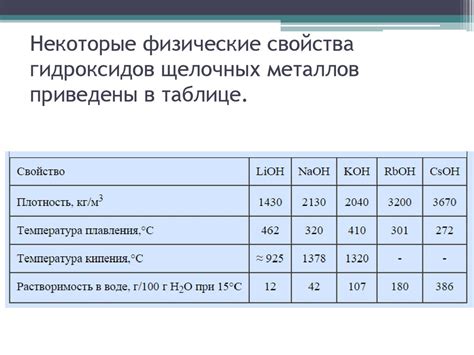
Щелочные металлы, такие как литий, натрий, калий и др., обладают особыми свойствами при взаимодействии с водой. Это связано с их низкой ионизацией и высокой электроотрицательностью.
При контакте с водой, щелочные металлы проявляют яркую реакцию, сопровождающуюся выделением водорода. Реакция протекает очень быстро и с выделением большого количества тепла. При этом образуются гидроксиды щелочных металлов.
Щелочные металлы реагируют с водой также и со сжиганием. В результате реакций образуется гидроксид соответствующего металла и освобождается водород. Реакция может быть настолько интенсивной, что в некоторых случаях может возникать пламя.
Стоит отметить, что реакция щелочных металлов с водой является экзотермической, то есть сопровождается выделением тепла. Благодаря этому свойству, щелочные металлы используются в пиротехнике и для получения взрывчатых веществ.
Щелочные металлы и активные металлы

Щелочные металлы являются группой элементов периодической системы, которые находятся в первой группе (1A). Эта группа включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают ярко выраженными металлическими свойствами.
Химические свойства щелочных металлов в значительной степени определяются их высокой степенью активности. Они обладают очень низкой электроотрицательностью и, следовательно, легко отдают свои электроны в химических реакциях.
Активные металлы, в отличие от щелочных металлов, находятся в других группах периодической системы, но также обладают схожими металлическими свойствами. Они легко реагируют с другими элементами, освобождая электроны и образуя положительно заряженные ионы. Примерами активных металлов являются алюминий (Al), кальций (Ca), магний (Mg), железо (Fe) и цинк (Zn).
Щелочные металлы и активные металлы имеют широкое применение в различных областях, включая производство легких сплавов, химической промышленности, электроэнергетики и др. Они также могут использоваться в различных экспериментах и исследованиях благодаря своим уникальным свойствам и реактивности.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий и калий, широко используются в различных отраслях промышленности благодаря своим уникальным металлическим свойствам.
Литий применяется в производстве легких алюминиевых сплавов, аккумуляторов и литиевых батарей. Использование литиевых батарей становится все более популярным в электромобилях, так как они обладают высокой энергетической плотностью и долгим сроком службы. Кроме того, литий используется в производстве стекол, керамики и фармацевтических препаратов.
Натрий применяется в производстве щелочей, стекловолокна, алюминия и мыла. Натриевые соединения используются в чистящих средствах, стекле и моющих средствах. Кроме того, натрий используется в пищевой промышленности для консервации и улучшения вкуса продуктов.
Калий применяется в производстве удобрений, стекла и мыла. Калийные удобрения являются важной составляющей сельского хозяйства, так как они обогащают почву необходимыми минералами для роста растений. Калийные соединения также используются в производстве стекла и мыла.
В целом, щелочные металлы играют важную роль в различных отраслях промышленности благодаря своим уникальным металлическим свойствам. Их широкое применение в производстве сплавов, батарей, удобрений, стекла и других материалов способствует развитию многих отраслей и обеспечивает нашу повседневную жизнь множеством необходимых продуктов и материалов.
Вопрос-ответ

Какие особенности металлических свойств щелочных металлов?
Основные особенности металлических свойств щелочных металлов – это высокая электропроводность, теплопроводность и пластичность. Они обладают металлическим блеском, образуют ионы положительного заряда и легко отдают электроны. Также они имеют низкую температуру плавления и кипения, а также низкие плотности. Некоторые щелочные металлы обладают способностью гореть на воздухе.
Каким образом выражаются металлические свойства щелочных металлов?
Металлические свойства щелочных металлов проявляются в их способности легко проводить электрический ток и тепло, а также быть формованными и деформированными без разрушения. Эти металлы обладают блеском и сиянием, являются хорошими проводниками электронов и образуют ионы положительного заряда в растворах. Кроме того, они обладают низкой температурой плавления и кипения, что делает их легкими и весьма распространенными элементами.
