Щелочные металлы - это группа элементов периодической системы, которые включают в себя литий, натрий, калий, рубидий, цезий и франций. Они получили свое название из-за того, что они образуют щелочные оксиды, то есть оксиды с щелочной реакцией. Щелочные металлы являются очень активными химическими элементами и имеют ряд особенностей, в том числе металлических свойств.
Одной из особенностей щелочных металлов является их низкая плотность. Все щелочные металлы имеют плотность меньшую, чем у воды, и поэтому они плавают на ее поверхности. Низкая плотность обусловлена образованием кристаллической решетки, в которой атомы металла находятся на больших расстояниях друг от друга.
Еще одной важной особенностью щелочных металлов является их мягкость. Они являются одними из самых мягких металлов и могут быть легко разрезаны ножом или непосредственно руками. Это свойство объясняется тем, что атомы металла легко передвигаются относительно друг друга.
Щелочные металлы также обладают хорошей электропроводностью. Они являются отличными проводниками тепла и электричества благодаря наличию свободных электронов в своей кристаллической решетке. Это позволяет им быть использованными в различных электронных устройствах и батареях.
В заключение, щелочные металлы обладают рядом уникальных металлических свойств, таких как низкая плотность, мягкость и хорошая электропроводность. Они являются важными элементами в различных сферах, включая промышленность и науку, и их свойства находят широкое применение в различных технологиях.
Физические свойства щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы Менделеева. Они отличаются высокой реактивностью и особыми физическими свойствами.
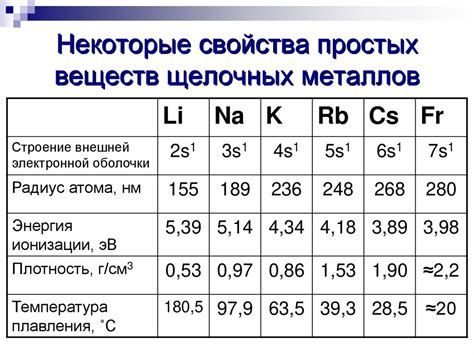
Плотность: Щелочные металлы обладают низкой плотностью. Например, литий имеет плотность всего 0,53 г/см³, в то время как уран, самый тяжелый из всех элементов, имеет плотность 19,1 г/см³.
Точка плавления: У щелочных металлов низкие точки плавления. Калий, например, плавится при температуре всего 63,5 °C, а цезий – при 28,4 °C.
Теплопроводность: Щелочные металлы являются хорошими проводниками тепла. Natrium, наиболее известный пример из группы, обладает высокой теплопроводностью – 142 Вт/(м·к).
Электропроводность: Щелочные металлы – хорошие проводники электричества. Они обладают малой электрической сопротивляемостью и низкой электрорезистивностью.
Мягкость: Щелочные металлы мягкие и податливые. Например, натрий может быть нарезан ножом или даже вытянут в тонкую проволоку.
Плотность электронов: У щелочных металлов очень низкая плотность электронов. Например, водород имеет только 1 электрон на внешней оболочке, а уровень заполнения электронов натрия составляет всего 2.
Химические свойства щелочных металлов

Щелочные металлы – это первая группа элементов периодической системы, куда входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают схожими химическими свойствами, отличающимися от свойств других групп элементов.
Щелочные металлы очень реактивны и легко образуют химические соединения. Они активно реагируют с водой, образуя щелочные растворы гидроксидов. Реакция с водой проходит с выделением водорода и образованием щелочи. Например, натрий реагирует с водой по следующему уравнению: 2Na + 2H2O → 2NaOH + H2.
Щелочные металлы также активно реагируют с кислородом, образуя оксиды. Например, натрий сгорает на воздухе, образуя оксид натрия: 4Na + O2 → 2Na2O. Щелочные металлы также сильные окислители и могут реагировать с другими элементами, образуя ионные соединения.
Одной из наиболее известных реакций щелочных металлов является реакция с хлором, при которой образуются соли хлористые. Например, реакция натрия с хлором приводит к образованию хлорида натрия: 2Na + Cl2 → 2NaCl.
Щелочные металлы также обладают способностью образовывать сплавы с другими металлами. Например, литий может образовывать сплавы с железом, алюминием и другими металлами. Эти сплавы обладают особыми свойствами и широко применяются в различных областях, включая производство аккумуляторов и специальных металлоконструкций.
Электронная структура щелочных металлов

Электронная структура щелочных металлов является одной из ключевых особенностей, определяющих их металлические свойства. Щелочные металлы, такие как литий, натрий и калий, характеризуются наличием одного электрона на внешнем энергетическом уровне. Этот электрон находится в s-орбитали, что делает щелочные металлы очень реактивными и легко окисляющимися.
Электронная структура щелочных металлов определяет их химическую активность. Из-за наличия одного электрона на внешнем энергетическом уровне, щелочные металлы стремятся отдать этот электрон и образовать ион положительного заряда. Это обусловлено энергетической нестабильностью ситуации, когда в изолированном атоме все уровни заполнены по парам электронов. Поэтому щелочные металлы хорошо реагируют с водой, кислородом и другими веществами.
Электронная структура щелочных металлов также играет роль в образовании их кристаллической решетки. Атомы щелочных металлов простоупорядоченно упаковываются в кристаллическую решетку. В этом процессе участвует внешний электрон, который образует "море" электронов, свободно перемещающихся между атомами. Это так называемый электронный газ, который объясняет высокую электропроводность и теплопроводность щелочных металлов.
Плотность щелочных металлов
Щелочные металлы представляют собой группу элементов периодической таблицы, которые относятся к первой группе и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы обладают высокой электропроводностью и реактивностью, а также обуславливают ряд уникальных свойств, включая их плотность.
Плотность щелочных металлов является характеристикой, обозначающей массу единицы объема вещества. Она измеряется в граммах на кубический сантиметр (г/см³). У всех щелочных металлов плотность сравнительно невысокая. Литий обладает наименьшей плотностью среди них и составляет около 0,53 г/см³. Плотность натрия составляет около 0,97 г/см³, калия - около 0,86 г/см³.
Плотность щелочных металлов зависит от их атомного и молекулярного строения, их атомного радиуса и взаимодействия между атомами. Более крупные атомы создают больший объем и приводят к увеличению плотности. Помимо этого, плотность может быть повышена за счет сжатия вещества при росте давления.
Использование щелочных металлов в различных отраслях науки и промышленности обусловлено их уникальными свойствами, включая низкую плотность. Это позволяет применять их в производстве легких и прочных конструкций, а также для создания специальных материалов и сплавов.
Температура плавления и кипения щелочных металлов

Щелочные металлы относятся к группе элементов, которые обладают низкой температурой плавления и кипения. Температура плавления - это температура, при которой металл переходит из твердого состояния в жидкое. Температура кипения, в свою очередь, это температура, при которой металл полностью переходит в газообразное состояние.
У щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, низкая температура плавления и кипения обусловлена наличием слабых межатомных сил. Щелочные металлы имеют одну валентность и образуют ионные соединения, что делает их атомы более легкими в сравнении с другими металлами.
Самая низкая температура плавления из всех щелочных металлов наблюдается у лития и составляет около 180 градусов Цельсия. Натрий плавится при температуре около 98 градусов Цельсия, калий - при 63 градусах Цельсия, рубидий - при 39 градусах Цельсия, а цезий - при 29 градусах Цельсия.
Температура кипения щелочных металлов также сравнительно низкая. Кипение лития начинается при температуре около 1342 градусов Цельсия, натрия - при 883 градусах Цельсия, калия - при 760 градусах Цельсия, рубидия - при 688 градусах Цельсия, а цезия - при 671 градусе Цельсия.
Низкая температура плавления и кипения щелочных металлов позволяет использовать их в различных приложениях, включая производство сплавов, аккумуляторов, синтез органических соединений и применение в ядерной энергетике.
Применение щелочных металлов в промышленности и науке
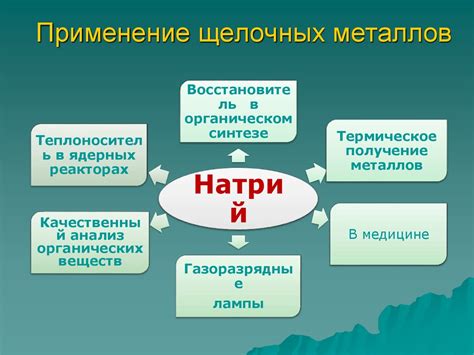
Литий находит широкое применение в аккумуляторах, особенно в литиевых ионных аккумуляторах, которые являются наиболее эффективными и легкими источниками энергии для портативных электронных устройств и электромобилей. Щелочные металлы также используют в производстве стекла, керамики и глины.
Натрий применяется в таких отраслях, как производство мыла, стекла и бумаги. Однако его основное применение связано с пищевой промышленностью: натрий используется в качестве консерванта и подкраски продуктов питания.
Калий часто используют в сельском хозяйстве в качестве удобрения, так как он необходим растениям для нормального роста. Калий также применяют в производстве мыла, стекла, бетона и ряда химических соединений.
Рубидий своими свойствами напоминает калий, но его применение ограничено из-за невысокой производственной доступности и высокой стоимости. Рубидий используют в оптике, в приборах для измерений и в некоторых видов лазеров.
Цезий применяется в медицине для лечения рака, а также в некоторых видах специальных стекол и камер для абсолютно чёрного тела. Он также используется в научных исследованиях в области физики элементарных частиц и в квантовых компьютерах.
Франций является самым редким элементом семейства щелочных металлов и имеет очень короткое время полураспада. Его применение в промышленности и науке пока ограничено, но его изучение может принести новые открытия в физике и химии.
Вопрос-ответ

Какие особенности проявляют щелочные металлы?
Основными особенностями щелочных металлов являются низкая плотность, низкая температура плавления и кипения, мягкость, хорошая проводимость электричества и тепла.
Почему щелочные металлы обладают металлическими свойствами?
Щелочные металлы обладают металлическими свойствами благодаря своей электронной структуре. У них один электрон в внешней оболочке, что обусловливает хорошую проводимость электричества и тепла.
