Металлы щелочного ряда, такие как натрий, калий и рубидий, обладают особенными свойствами, которые делают их идеальными основаниями. Один из способов получения оснований из металлов щелочного ряда - это процесс окисления, при котором образуется основной оксид. Основной оксид - это химическое соединение металла с кислородом. Они являются нерастворимыми в воде и проявляют щелочные свойства при взаимодействии с водой.
Основные оксиды металлов щелочного ряда имеют высокую основность и могут реагировать с кислородными кислотами, образуя соли. Соли металлов щелочного ряда также обладают основными свойствами и также являются нерастворимыми в воде. Это связано с тем, что основные оксиды и соли образуют кристаллическую решетку, которая не позволяет воде проникать внутрь структуры.
Нерастворимые основания, такие как основные оксиды и соли металлов щелочного ряда, находят широкое применение в различных отраслях промышленности. Они используются в производстве стекла, мыла, щелочных батарей, а также в качестве катализаторов в химических реакциях. Благодаря своей нерастворимости в воде, они стабильны и могут быть использованы в условиях высоких температур и концентраций.
В заключение, металлы щелочного ряда обладают особенными свойствами, которые делают их идеальными основаниями. Основные оксиды и соли, образуемые этими металлами, являются нерастворимыми в воде и обладают высокой основностью. Эти нерастворимые основания находят широкое применение в различных отраслях промышленности, благодаря своей стабильности и способности работать в условиях высоких температур и концентраций.
Металл щелочь: основной оксид
Металлы щелочи – это элементы, которые находятся в первой группе периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Одной из характерных свойств металлов щелочи является образование основных оксидов, которые растворяются в воде и образуют щелочные растворы.
Основной оксид – это вещество, которое образуется при соединении металла щелочи с кислородом. Он имеет формулу M2O, где M обозначает металл. Например, оксид лития имеет формулу Li2O, а оксид натрия – Na2O. Основные оксиды обладают выраженными щелочными свойствами, то есть они образуют растворы с щелочной реакцией.
Растворение основных оксидов в воде приводит к образованию щелочных растворов. При этом происходит реакция оксида с водой, в результате чего образуются гидроксиды металлов щелочи. К примеру, оксид лития растворяется в воде с образованием литиевого гидроксида (LiOH), а оксид натрия – натриевого гидроксида (NaOH).
Основные оксиды и их растворы, то есть гидроксиды, широко используются в различных областях жизни и промышленности. Они являются важными компонентами в производстве жидких и твердых щелочей, используются в процессе щелочной электролиза и в качестве катализаторов в реакциях органического синтеза.
Соль нерастворимое основание

Соль – это химическое соединение, образующееся при замещении ионов водорода в кислоте ионами металла или группы металлов. Соли широко применяются в различных областях жизни, в том числе в пищевой промышленности, медицине и химической промышленности.
Нерастворимые соли – это соли, которые плохо растворяются в воде или в других растворителях. В отличие от растворимых солей, нерастворимые соли образуют осадок при контакте с водой и не образуют прозрачные растворы. Осадок нерастворимых солей может быть разного цвета и текстуры.
Нерастворимые соли являются нерастворимыми основаниями, то есть они взаимодействуют с водой, образуя щелочные растворы. Данные соли не растворимы в воде, но в щелочной среде они диссоциируют на ионы, проявляя свои основные свойства. Например, нерастворимая соль меди (II) оксид (CuO) при контакте с водой превращается в гидроксид меди (II) (Cu(OH)2), образуя щелочную среду.
Примерами нерастворимых оснований металл щелочь могут быть соли гидроксидов: оксид бария (BaO), оксид кальция (CaO), оксид стронция (SrO). Данные вещества обладают основными свойствами при взаимодействии с водой, образуя щелочные растворы. Например, оксид бария при контакте с водой образует гидроксид бария (Ba(OH)2), который проявляет щелочные свойства и может использоваться в процессах нейтрализации кислот.
Основы и оксиды: общая информация

Основы и оксиды являются важными химическими соединениями, активно применяемыми в различных областях науки и промышленности. Основы представляют собой химические соединения, обладающие выраженными щелочными свойствами. Они способны вступать в реакцию с кислотами для образования солей и воды.
Наиболее распространенными основами являются гидроксиды металлов, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH). Они широко используются в промышленности и быту, например, для производства мыла и моющих средств, регулирования уровня pH в различных процессах.
Оксиды, в свою очередь, представляют собой химические соединения, состоящие из металлического элемента и кислорода. Оксиды металлов обладают разнообразными свойствами и могут быть как кислыми, так и основными. Кислые оксиды реагируют с водой, образуя кислоты, в то время как основные оксиды образуют щелочные растворы.
Соль, как нерастворимое основание, является важным классом химических соединений. Соли образуются в результате реакции кислоты с основанием, при этом происходит замещение одной или нескольких ионных групп в молекуле кислоты. Соли широко используются в медицине, производстве пищевых продуктов, сельском хозяйстве и других отраслях промышленности.
Алкалины: основной оксид и соль
Алкалины - это группа элементов в периодической таблице, которые имеют сходные свойства и химическое поведение. Они включают литий, натрий, калий, рубидий и цезий.
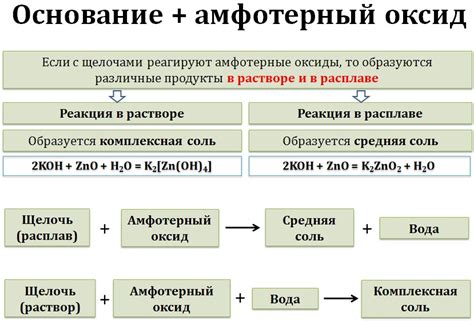
Основной оксид - это соединение алкалина с кислородом. Они обладают выраженными основными свойствами и используются в различных отраслях промышленности и научных исследованиях. Например, гидроксиды алкалин может использоваться в качестве катализаторов или в процессах обработки материалов.
Соли алкалин также являются нерастворимыми основаниями. Они образуются при реакции алкалина с кислотой. Эти соли имеют особую структуру и обладают высокой стабильностью. Они используются в различных областях, например, в медицине, для производства лекарственных препаратов, а также в пищевой промышленности, как добавки для сохранения пищевых продуктов.
В целом, алкалины, их основные оксиды и соли играют важную роль в химической промышленности и других областях, их свойства и применение позволяют существенно улучшить различные процессы и создать новые материалы и продукты.
Металл щелочь и его свойства
Металл щелочь – это класс элементов периодической системы химических элементов, который включает в себя литий, натрий, калий, рубидий, цезий и франций. Особенностью металлов щелочи является то, что они обладают высокой степенью реакционной способности. Это связано с их электрохимическими свойствами и низкой степенью ионизации.
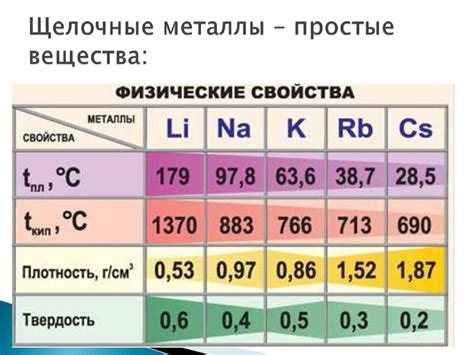
Металлы щелочи обладают такими химическими свойствами, как низкая плотность, мягкость, низкая температура плавления, способность реагировать с кислотами и водой. Они образуют нерастворимые основания, которые называют щелочами. Кроме того, металлы щелочи имеют высокую электропроводность и хорошо проводят тепло.
Интересной особенностью металлов щелочи является их способность образовывать оксиды с химической формулой М2O (где М – металл щелочи). Оксиды этих металлов обладают амфотерными свойствами, то есть они могут реагировать как с кислотами, так и с основаниями. Это обусловлено их способностью давать и принимать протоны.
Металлы щелочи являются важными веществами в биохимии и медицине. Они широко применяются в различных отраслях промышленности, в основном в производстве промышленных химикатов, батареек, стекла и прочих материалов. Кроме того, металлы щелочи широко применяются в лабораторных условиях для выполнения различных химических реакций и исследований.
Металл щелочь: особенности оксидов

Металлы щелочные элементы первой группы периодической системы химических элементов образуют щелочные оксиды – химические соединения сисобой формой оксида.
Оксиды щелочных металлов обладают рядом характерных особенностей. Они образуют кристаллические соединения с высоким плавлением и кипением, что говорит о крепкой объединенности атомов внутри молекулы оксида.
Вода взаимодействует с оксидами таким образом, что получаются щелочные растворы, а углекислый газ нейтрализует предметные основания и образует нерастворимые соли металлов щелочных элементов. Процесс растворения оксида в воде сопровождается выделением большого количества тепла, что наглядно демонстрирует силу оснований.
Химические основания - это вещества, которые в воде образуют отрицательные OH- ионные радикалы, присутствие которых дает среде основной характер. Оксиды металлов щелочного ряда являются наиболее сильными основаниями. Они энергично реагируют с водой, образуя гидроксиды и свободные активные кислородистые группы.
Щелочные оксиды также обладают амфотерными свойствами. Они могут реагировать и с кислотами, и с основаниями. В результате взаимодействия с кислотами образуются соли, а при реакции с основаниями - пероксиды. Такое поведение связано с высокой реакционной способностью и способностью образовывать разнообразные соединения.
Нерастворимые основания: основы химии

Основы химии изучают свойства и взаимодействие различных веществ. Известно, что основаниями называют вещества, способные образовывать гидроксиды и выделять гидроксидионы в водных растворах. Некоторые основания, называемые нерастворимыми основаниями, образуют нерастворимые соли с кислотами. В этом случае речь идет о металлических основаниях, которые являются оксидами металлов, сочетающихся с водой.
Нерастворимые основания представляют собой оксиды металлов, которые часто используются в различных областях. Файлосфат является одним из примеров нерастворимого основания. Это соединение содержит Р-химический элемент, от которого и происходит его название. Файлосфат образует нерастворимые соли с кислотами и имеет важное применение в промышленности, в агрохимии и в медицине.
Нерастворимые основания имеют широкое применение. Так, гидрооксид алюминия, также известный как алюминий гидроксид, является эффективным коагулянтом в обработке воды и сточных вод. Он активно применяется для удаления загрязнений и подавления роста бактерий. Кроме того, алюминий гидроксид используется в фармацевтической и косметической промышленности.
Нерастворимые основания играют важную роль в химической промышленности. Например, гидроксид натрия, также известный как едкий или каустический калий, используется для изготовления моющих средств, стекла, бумаги, текстиля и других продуктов. Бариевая свеча, которая содержит нерастворимое основание - гидрооксид бария, используется в рентгенологии для получения изображений внутренних органов.
Соли щелочных металлов: применение
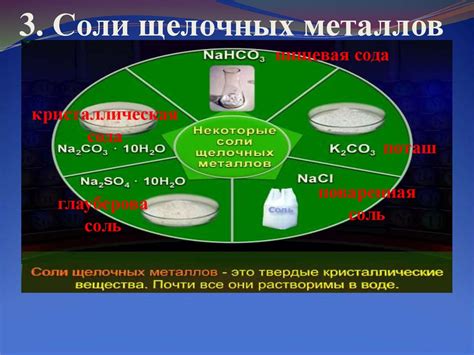
Соли щелочных металлов имеют широкое применение в различных областях нашей жизни.
Одной из основных областей применения солей щелочных металлов является химическая промышленность. Соли щелочных металлов широко используются в качестве катализаторов при производстве различных химических веществ. Их присутствие в реакционной среде позволяет ускорить химические реакции и повысить их эффективность.
Еще одной важной областью применения солей щелочных металлов является производство стекла. Соли калия, натрия и лития используются в процессе плавления стекла, что позволяет придать ему определенные свойства, такие как прозрачность и прочность. Благодаря солям щелочных металлов стекло становится основным материалом для производства различных изделий, от окон и зеркал до посуды и электронных устройств.
Соли щелочных металлов также находят применение в пищевой промышленности. Они используются в качестве консервантов и добавок в производстве пищевых продуктов. Соли натрия применяются для придания пище приятного вкуса, а также для регулирования ее pH-уровня. Благодаря солям щелочных металлов продукты могут иметь длительный срок годности и лучше сохранять свое качество.
Кроме того, соли щелочных металлов используются в медицине. Например, соль калия применяется для обеспечения нормальной работы сердечно-сосудистой системы. Соли натрия используются для восстановления водно-электролитного равновесия в организме, а также в качестве антисептических средств. Они используются для обработки ран и ожогов, а также для очистки и дезинфекции медицинского оборудования.
Вопрос-ответ

Какие металлы принадлежат к группе щелочных металлов?
К группе щелочных металлов относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Что такое основной оксид?
Основной оксид - это оксид металла, который обладает щелочными свойствами, то есть способностью реагировать с кислотами и образовывать с ними соль и воду.
