Металл оксид металла – это химическое соединение, состоящее из металла и кислорода. Оксиды металлов обладают широким спектром свойств и находят применение во многих областях науки и промышленности. Реакции оксидов металлов с другими веществами позволяют получать полезные продукты и использовать их в различных процессах.
Одной из важнейших реакций, которую проявляют оксиды металлов, является их способность растворяться в воде и образовывать основные растворы. В результате этой реакции металлический оксид образует гидроксид металла, который обладает щелочными свойствами. Так, например, реакцией оксида алюминия с водой образуется гидроксид алюминия, широко применяемый в качестве катализатора и вещества для удаления вредных примесей из воды.
Еще одной важной реакцией, свойственной оксидам металлов, является их способность окисляться и восстанавливаться. Оксиды металлов могут служить как окислителями, так и восстановителями в различных химических реакциях. Например, оксид железа Fe2O3 является окислителем в реакциях с восстановителями, такими как углерод или алюминий. При этом оксид железа восстанавливается до металлического железа.
Таким образом, металл оксид металла представляет собой важное химическое соединение с разнообразными свойствами и реактивностью. Его реакции с водой и веществами, обладающими окислительными или восстановительными свойствами, позволяют использовать оксиды металлов в различных областях науки и промышленности.
Примеры реакций металл-оксидных соединений
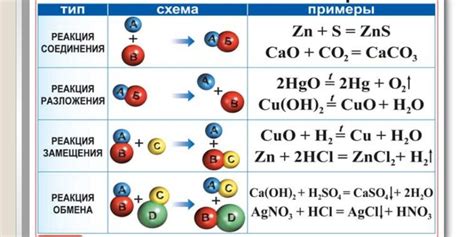
Металл-оксидные соединения представляют собой химические соединения, в которых металл соединяется с кислородом. Они могут образовываться при воздействии кислорода на металлы или при реакции кислоты с основанием.
Одним из примеров реакций металл-оксидных соединений является реакция меди (Cu) с кислородом (O). При нагревании медь соединяется с кислородом из воздуха и образуется медный оксид (CuO). Эта реакция имеет место, например, при образовании зеленого налета на поверхности медных предметов.
Другим примером реакции металл-оксидного соединения является реакция железа (Fe) с кислородом (O). В результате этой реакции образуется железный оксид (FeO) или железная ржавчина. Реакция происходит при окислении железа влагой и кислородом, которые присутствуют в воздухе. Железная ржавчина является хрупким и неустойчивым соединением.
Еще одним примером реакции металл-оксидного соединения является реакция алюминия (Al) с кислородом (O). При нагревании алюминий соединяется с кислородом и образуется алюминиевый оксид (Al2O3), который широко используется в производстве керамики и огнеупорных материалов. Алюминиевый оксид также является основным составным элементом в минерале боксит.
Взаимодействие металл-оксидов с кислотами
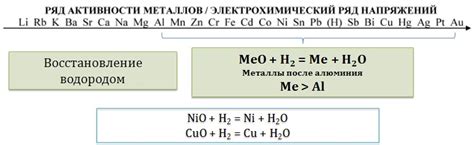
Металл-оксиды - это неорганические соединения, состоящие из металлического и кислородного атомов. Они обладают свойствами щелочных или амфотерных веществ, что позволяет им взаимодействовать с кислотами.
Когда металл-оксид взаимодействует с кислотой, происходит реакция нейтрализации, при которой образуется соль и вода. В результате этой реакции ионы гидроксидов, содержащиеся в металл-оксиде, соединяются с ионами водорода кислоты, образуя молекулы воды и соль. Например, при взаимодействии оксида натрия (Na2O) с соляной кислотой (HCl) образуется хлорид натрия (NaCl) и вода (H2O).
Реакция взаимодействия металл-оксидов с кислотами может быть представлена следующим образом:
| Металл-оксид | Кислота | Соль | Вода |
|---|---|---|---|
| Na2O | HCl | NaCl | H2O |
| Fe2O3 | H2SO4 | Fe2(SO4)3 | H2O |
| CaO | HNO3 | Ca(NO3)2 | H2O |
Взаимодействие металл-оксидов с кислотами имеет большое практическое значение. Например, раствор щелочей, получаемый при взаимодействии щелочных металл-оксидов с кислотами, используется в различных отраслях промышленности, например, при производстве мыла или в процессе очистки воды.
Свойства металл-оксидных соединений

Металл-оксидные соединения имеют ряд характерных свойств, которые определяются структурой и химическим составом данных соединений.
Во-первых, металл-оксидные соединения обладают высокой термической и химической стабильностью. Это означает, что они не разлагаются при повышенных температурах и не подвергаются воздействию большинства химических веществ. Благодаря этому свойству металл-оксидные соединения широко используются в различных промышленных процессах.
Во-вторых, металл-оксидные соединения обладают хорошей проводимостью электричества и тепла. Это свойство возникает благодаря наличию свободных электронов или ионов в их структуре. Благодаря хорошей электрической проводимости металл-оксидные соединения широко применяются в электротехнике и электронике.
Кроме того, металл-оксидные соединения обладают высокой твердостью и прочностью. Они являются тугоплавкими и обладают высокой плотностью. Благодаря этому свойству, металл-оксидные материалы широко используются в производстве жаропрочной керамики, сплавов и других материалов, которые должны выдерживать высокие нагрузки и температуры.
В целом, свойства металл-оксидных соединений делают их важными и полезными материалами в различных областях науки и промышленности. Исследования в данной области продолжаются, и ученые постоянно находят новые способы использования этих материалов для создания новых технологий и материалов с улучшенными свойствами.
Вопрос-ответ

Какие примеры реакций с металлическим оксидом металла вы можете привести?
Примеры реакций с металлическим оксидом металла включают реакцию окисления-восстановления, образование солей и взаимодействие с кислотами. Например, реакция металлического оксида металла с кислородом может привести к образованию металлического оксида. Реакция с кислотой может привести к образованию соли и воды. Зачастую, реакция окисления-восстановления происходит с участием водорода.
Каковы основные свойства металлических оксидов металла?
Металлические оксиды металла обычно являются твердыми веществами, обладающими высокой температурой плавления. Они встречаются в разных цветах: от белого и желтого до черного. Металлические оксиды металла растворимы в кислотах и реагируют с ними, образуя соли и воду. Они также могут взаимодействовать с водородом при реакции окисления-восстановления.
