Электролиты – это химические вещества, состояние которых в растворе обусловлено наличием свободных ионов. Они могут быть катионами, анионами или обоими одновременно.
Катионы металла и водорода – это положительно заряженные ионы, которые образуются в результате ионизации соответствующих атомов. Катионы металла имеют положительный заряд и играют важную роль в различных процессах, таких как проведение электричества или создание электрического потенциала.
Анионы кислотного остатка – это отрицательно заряженные ионы, которые образуются при диссоциации кислоты. Они могут быть представлены различными элементами, их сочетаниями или атомами с необычной структурой.
Электролиты имеют особые свойства и влияют на различные процессы в организме. Они играют важную роль в проведении нервных импульсов, сократительной активности мышц, поддержании кислотно-щелочного баланса и других жизненно важных функциях. Более того, электролитические растворы используются в медицине для восполнения потери электролитов и влияют на эффективность таких процедур, как электролитическая дезинфекция и электролиз.
Используя знание о катионах металла и водорода, а также анионах кислотного остатка, мы можем лучше понять основы химии и ее влияние на различные системы в нашем мире, включая человеческий организм.
Катионы металла: что это и какое воздействие они оказывают?

Катионы металла - это положительно заряженные ионы металлов, которые образуются при потере одного или нескольких электронов. Эти ионы играют важную роль в химических реакциях и воздействуют на различные системы организма.
Катионы металла могут проявлять различные свойства и оказывать разнообразное воздействие на окружающую среду. Они способны образовывать соединения с отрицательно заряженными анионами, такими как кислород, сера или фосфор, образуя стабильные соли. Эти соли могут использоваться в промышленности, медицине, сельском хозяйстве и других отраслях.
Некоторые катионы металла имеют toсложную структуру и способны образовывать комплексы с различными лигандами. Это свойство позволяет им взаимодействовать с различными органическими соединениями, в том числе с белками и ферментами. Такие взаимодействия способны оказывать влияние на биохимические процессы и могут быть использованы для лечения различных заболеваний.
Некоторые катионы металла являются необходимыми микроэлементами для организма человека и других живых существ. Они участвуют в регуляции работы различных физиологических систем и играют важную роль в обмене веществ. Однако, при избытке этих катионов в организме может возникнуть токсическое воздействие, что может привести к различным заболеваниям и нарушениям.
Таким образом, катионы металла являются важными химическими соединениями, которые могут оказывать разнообразное воздействие на окружающую среду и организмы. Понимание их свойств и взаимодействия может помочь в различных областях науки и промышленности и способствовать созданию новых материалов и методов лечения заболеваний.
Катионы металла - основа электролитов
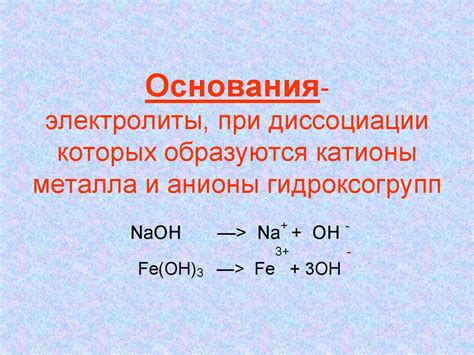
Электролиты - это вещества, которые способны ионизироваться в растворе и проводить электрический ток. В основе электролитов лежат ионы, которые образуются в процессе диссоциации в водных растворах. Катионы металла являются одним из основных видов ионов, которые составляют электролиты.
Катионы металла образуются в результате потери одного или нескольких электронов атомом металла. Эти катионы заряжены положительно и представляют собой активные частицы, способные перемещаться в растворе. Важно отметить, что катионы металла могут образовывать различные соединения с анионами кислотного остатка, такими как гидроксидные, хлоридные или сульфатные соединения.
Катионы металла воздействуют на свойства и поведение электролитов. Они обеспечивают электропроводность раствора и влияют на его физические свойства, такие как вязкость и растворимость. Более того, катионы металла могут быть использованы для придания определенных свойств электролитам, таких как изменение pH или электрохимического потенциала раствора.
Катионы металла являются неотъемлемой частью множества важных процессов в живых организмах, технологических производствах и химических реакциях. Они играют ключевую роль в электролитических испытаниях, гальванических элементах, электроосаждении металла и других электрохимических процессах. Понимание свойств и поведения катионов металла является существенным для разработки новых электролитических систем и улучшения существующих технологий.
Водородные катионы: их роль и действие

Водородные катионы (H+) являются одним из основных типов катионов, которые могут присутствовать в растворах электролитов. Они образуются при диссоциации молекул кислоты в воде. Водородные катионы играют важную роль в химических реакциях и имеют значительное воздействие на свойства растворов.
Вода является универсальным растворителем и способна растворять различные вещества. При растворении кислоты в воде, молекулы кислоты диссоциируются на ионы водорода и анионы кислотного остатка. Водородные катионы имеют положительный заряд и образуются из водорода иона, потерявшего свой электрон.
Вода является средой, в которой водородные катионы проявляют свои свойства. Они обеспечивают проводимость раствора, позволяя электрическим зарядам перемещаться сквозь раствор. Благодаря наличию водородных катионов, растворы кислот проявляют кислотные свойства, способность реагировать с основаниями и образовывать соли.
Водородные катионы также играют важную роль в поддержании кислотно-щелочного баланса в организме. Они участвуют в реакциях, связанных с основными функциями организма, включая регулирование электролитного баланса и поддержание оптимального pH внутренней среды.
В итоге, водородные катионы являются важными компонентами растворов электролитов. Они обладают специфическими свойствами, которые определяют их роль и действие в химических процессах и важность для жизнедеятельности организма.
Водородные катионы влияют на степень кислотности

Водородные катионы (H+) играют важную роль в регуляции степени кислотности среды. Вода, в отличие от многих других веществ, является слабой электролитической средой. Однако при взаимодействии с кислотами вода может возникать водородный ион (H+), который обладает положительным зарядом.
Степень кислотности среды определяется концентрацией водородных ионов. Чем больше водородных ионов присутствует в растворе, тем более кислая среда. Наоборот, если концентрация водородных ионов низкая, то среда будет щелочной или нейтральной.
Переход водородного иона от одной молекулы к другой является основным механизмом образования ионов водорода и кислотных реакций. Кроме того, водородные катионы могут проникать в клетки организма и влиять на функционирование различных органов и систем.
Важно отметить, что воздействие водородных катионов на организм может быть как положительным, так и отрицательным. Например, водородные катионы играют ключевую роль в кислородном обмене и энергетических процессах организма. Однако, при избыточном накоплении водородных ионов в организме может возникать кислотоз, что может привести к различным заболеваниям.
Анионы кислотного остатка: что это и как они работают?

Анионы кислотного остатка - это негативно заряженные ионы, образующиеся как результат диссоциации кислот в водном растворе. Каждая кислота имеет свой характерный анионный кислотный остаток, который определяет ее свойства и реактивность. Например, в серной кислоте (H2SO4) анионным кислотным остатком является сульфатный ион (SO42-), в хлорной кислоте (HCl) - хлоридный ион (Cl-).
Анионы кислотного остатка играют важную роль в химических реакциях и могут быть использованы в различных технологических процессах. Например, сульфатные ионы (SO42-) могут быть использованы для осаждения металлов в виде нерастворимых сульфатов, а нитратные ионы (NO3-) - для производства удобрений и пиротехнических смесей.
Анионы кислотного остатка также могут взаимодействовать с катионами металла, образуя соли. Например, анион хлорида (Cl-) может связываться с катионами натрия (Na+) и образовывать хлорид натрия (NaCl), который является примером электролита, способного проводить электрический ток в растворе.
Важной особенностью анионов кислотного остатка является их способность активно реагировать с другими веществами, образуя новые соединения. Например, сульфатные ионы (SO42-) могут образовывать сложные двойные соли с другими ионами, что является основой многих промышленных процессов и технологий.
Анионы кислотного остатка - ключевые элементы электролитов

Электролиты - это вещества, которые при растворении или плавлении образуют ионные растворы или плавы. Они играют важную роль в химических реакциях и метаболических процессах организма.
Анионы кислотного остатка являются одним из ключевых элементов электролитов. Кислотный остаток - это атом или группа атомов, которые остаются после отщепления одного или нескольких протонов из кислоты.
Примеры анионов кислотного остатка включают в себя ацетат (CH3COO-), сульфат (SO42-), нитрат (NO3-) и фосфат (PO43-).
Анионы кислотного остатка могут быть положительно или отрицательно заряженными в зависимости от количества протонов, которые они отщепляют или принимают. Они обладают электрической проводимостью и способны передавать электрический заряд через раствор или плаву.
Когда электролиты растворяются в воде, анионы кислотного остатка и катионы металла разделяются и становятся свободными в растворе. Они образуют ионный раствор, который может проводить электрический ток. Это делает электролиты полезными в различных процессах, таких как электролиз, гальванические элементы и электрохимические реакции.
Важно отметить, что анионы кислотного остатка не являются единственными ионами в электролитах. Они соседствуют с катионами металла, такими как натрий (Na+), калий (K+) или магний (Mg2+), создавая электрическую нейтральность в растворе.
Вопрос-ответ

Для чего нужны электролиты?
Электролиты играют важную роль в многих процессах, таких как передача нервных импульсов, сокращение мышц, поддержание pH баланса и участие в обмене веществ. Они также используются в различных отраслях промышленности, медицине и электронике.
Как электролиты воздействуют на организм человека?
Электролиты помогают поддерживать баланс жидкостей в организме, регулируют сокращение мышц, помогают проводить нервные импульсы и поддерживают нормальную работу сердца. Если уровень электролитов в организме слишком низкий или слишком высокий, это может привести к различным проблемам со здоровьем.
Какие виды электролитов существуют?
Существует множество видов электролитов, но основными являются катионы металла (например, натрий, калий, кальций) и водород, а также анионы кислотного остатка (например, хлор, гидроксид, сульфат).
Что происходит, когда электролиты растворяются в воде?
Когда электролиты растворяются в воде, они диссоцируются на положительно и отрицательно заряженные частицы, называемые ионами. Эти ионы свободно перемещаются в растворе и могут проводить электрический ток.
Каким образом электролиты используются в промышленности?
Электролиты используются в промышленности для различных целей. Они могут быть использованы в процессах электролиза для разделения веществ на компоненты, в батареях для хранения и поставки энергии, а также в производстве химических соединений и лекарственных препаратов.
