В химии соли представляют собой соединения, которые образуются в результате реакции кислоты и основания. В жидком состоянии соли образуют растворы, которые могут быть разбавленными. Реактивность разбавленных солей может быть различной, в зависимости от взаимодействия металлической части соли с веществами, находящимися в растворе. В данной статье мы рассмотрим, какие металлы могут вступать в химическую реакцию при разбавлении солей.
Первый фактор, который влияет на реактивность разбавленных солей, - это степень окисления металла. Металлы с более высокими степенями окисления, такие как железо, алюминий и магний, обладают более высокой реактивностью и могут вступать в химические реакции с различными веществами в растворе. Например, металлы с низкими степенями окисления, такие как свинец или медь, могут быть менее реактивными и, следовательно, могут проявлять меньшую реакцию при разбавлении их солей.
Второй фактор, который влияет на реактивность разбавленных солей, - это взаимодействие металла с другими веществами в растворе. Некоторые металлы могут реагировать с водой, образуя гидроксиды, газы или другие продукты. Например, натрий реагирует с водой, образуя гидроксид натрия и водород. Другие металлы могут вступать в реакцию с кислотами, освобождая водородный газ. Таким образом, различные комбинации металлов и веществ в растворах солей могут приводить к различным химическим реакциям.
В заключение, реактивность разбавленных солей зависит от степени окисления металла и его взаимодействия с другими веществами в растворе. Металлы с более высокими степенями окисления и способностью реагировать с водой или кислотами обычно проявляют более высокую реактивность. Зная свойства различных металлов, можно предсказать их поведение при разбавлении их солей и использовать эту информацию в различных химических процессах и реакциях.
Влияние разбавленной соли
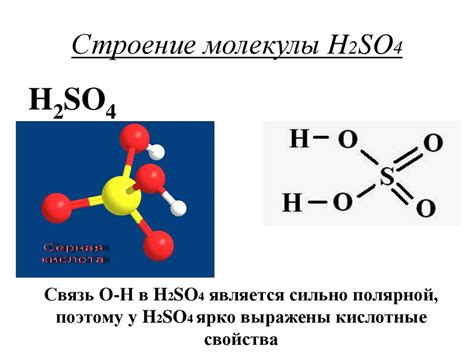
Разбавленные соли являются важными компонентами в химических реакциях и имеют значительное влияние на их характеристики и свойства. Металлы, содержащиеся в разбавленной соли, обладают различными степенями реактивности, что определяет их способность участвовать в химических процессах.
Взаимодействие разбавленной соли с другими веществами может привести к образованию новых химических соединений, смене их физических свойств или даже возникновению реакционной способности. Некоторые металлы могут проявлять эффект катализатора, ускоряя химические реакции, в то время как другие металлы могут выступать в роли ингибиторов, замедляя протекание процессов.
Например, разбавленные соли меди (Cu) и железа (Fe) имеют высокую реакционную активность и способность вступать во многие химические реакции. Они могут образовывать соединения с кислородом, нитрогеном, серой и другими элементами, что делает их важными компонентами в производстве различных соединений и материалов.
С другой стороны, разбавленные соли золота (Au) и платины (Pt) обычно являются более инертными и мало реактивными. Они часто используются в ювелирных изделиях и различных электронных устройствах благодаря своей стабильности и низкой химической активности.
Роль концентрации

Концентрация разбавленной соли играет важную роль в ее реактивности. Чем выше концентрация раствора соли, тем больше металлов может вступить в химическую реакцию.
При низкой концентрации раствора соли, большая часть металлов остается в виде ионов и не проявляет своей реактивности. Однако, при увеличении концентрации, большее количество металлов может связаться с другими веществами и претерпеть химические изменения.
Например, если в растворе со сниженной концентрацией присутствует железо, оно может оставаться неактивным и не вступать в реакцию с другими веществами. Но при более высокой концентрации, железо может реагировать с кислородом из воздуха и образовывать ржавчину.
Таким образом, высокая концентрация разбавленной соли может способствовать активации и реактивности металлов, что делает ее более подверженной химическим изменениям в сравнении с низкой концентрацией.
Зависимость от ионной формы

Реактивность разбавленной соли зависит от ионной формы металла, который содержится в растворе. Различные металлы могут вести себя по-разному в химической реакции, взаимодействуя с другими веществами. Эти различия объясняются свойствами ионов, которые образуются при диссоциации соли в воде.
Например, некоторые металлы, такие как натрий и калий, образуют катионы, которые обладают положительным зарядом. Эти ионы могут быть очень реактивными и вступать в химические реакции с водой или другими веществами. Такие реакции могут приводить к образованию газов, выпадению осадков или изменению цвета раствора.
С другой стороны, некоторые металлы, такие как цинк или железо, образуют ионы, которые обладают положительным зарядом, но менее реактивны по сравнению с натрием или калием. Они могут вступать в химические реакции только при определенных условиях, например, при наличии сильных окислителей или кислот.
Еще одной важной особенностью ионной формы металла является его способность образовывать соединения с различными анионами. Например, некоторые металлы, такие как серебро или медь, могут образовывать агенты окисления или катализаторы при взаимодействии с соответствующими анионами. Эти реакции могут иметь применение в различных процессах, включая электрохимические реакции или синтез органических соединений.
Взаимодействие с щелочными металлами

Разбавленные соли реагируют с щелочными металлами, такими как натрий, калий и литий. Эти металлы вступают в химическую реакцию с разбавленными солями, образуя гидроксиды металлов и выделяя газ в виде пузырьков.
Реакция между разбавленными солями и щелочными металлами происходит очень быстро и сопровождается выделением тепла. Щелочные металлы, такие как натрий и калий, имеют низкую электроотрицательность и легко отдают свой внешний электрон, чтобы образовать положительный ион. Разбавленные соли, напротив, обладают высокой электроотрицательностью и имеют способность принимать электроны, образуя отрицательные ионы.
В результате взаимодействия разбавленной соли с щелочным металлом происходит обмен электронами, и образуются гидроксиды металлов – щелочи. Гидроксиды щелочных металлов являются щелочными растворами, которые имеют высокий уровень pH и обладают щелочными свойствами. В результате такой реакции может образовываться медленно растворяющийся осадок, который можно предложить для наблюдения присутствующим веществам.
Активность металлов: калий, натрий и литий

Металлы калия, натрия и лития являются одними из самых активных металлов в химической реакции. Они легко взаимодействуют с водой и вступают в реакцию с разбавленной солью.
Калий (K) является мягким серебристо-белым металлом, который быстро реагирует с водой. При контакте с водой калий выделяет газ водород и образует щелочную среду. В результате реакции образуется гидроксид калия (KOH).
Натрий (Na) также является активным металлом, который быстро реагирует с водой. При контакте с водой натрий зажигается и сильно шипит. В результате реакции образуется гидроксид натрия (NaOH) и выделяется газ водород.
Литий (Li) является наиболее активным металлом среди всех щелочных металлов. При контакте с водой литий немедленно реагирует, быстро нагревается и может воспламениться. Реакция лития с водой приводит к образованию гидроксида лития (LiOH) и выделению водорода.
Влияние на поверхность металла
Реактивность разбавленной соли зависит от вида металла и его поверхности. Поверхность металла играет важную роль в химической реакции. Характеристики поверхности, такие как ее состояние, форма, размер и шероховатость, могут существенно влиять на скорость и интенсивность реакции.
Металлическая поверхность обладает активными центрами, на которых происходят химические реакции. Чем больше активных центров на поверхности металла, тем выше его реактивность. Поверхность металла может быть увеличена путем создания мельчайшего порошка или с использованием специальных катализаторов.
Также важно отметить, что поверхность металла может окисляться или покрываться слоем производных продуктов реакции. Это может препятствовать реакции или изменять ее характер. Например, окисление поверхности железа приводит к образованию ржавчины, которая является сложным смесью оксидов железа и может замедлить реакцию.
Таким образом, поверхность металла имеет большое значение в химической реакции с разбавленной солью. Ее состояние, количество активных центров и наличие окисленных слоев могут как способствовать, так и затруднять протекание реакции. Подробное изучение этих факторов позволяет более точно определить влияние различных металлов на химическую реакцию и разработать эффективные катализаторы для ускорения процессов в различных промышленных отраслях.
Взаимодействие с щелочноземельными металлами
Разбавленные соли могут вступать в химическую реакцию с щелочноземельными металлами, такими как магний, кальций, стронций и барий. Эти металлы относятся к группе элементов с двумя валентностями и характеризуются низкой активностью.
Взаимодействие разбавленных солей с щелочноземельными металлами может приводить к образованию осадков или газов. Например, при взаимодействии разбавленных солей с магнием может образовываться гидроксид магния (Mg(OH)2).
Взаимодействие с щелочноземельными металлами может быть полезным для осаждения и очистки различных веществ. В некоторых случаях, образование осадков позволяет удалить из раствора нежелательные примеси, повышая чистоту и качество продукта.
- Магний (Mg): взаимодействие с разбавленными солями может привести к образованию осадка гидроксида магния (Mg(OH)2)
- Кальций (Ca): может образовывать осадок карбоната кальция (CaCO3) или гидроксида кальция (Ca(OH)2)
- Стронций (Sr): может образовывать осадок стронций сульфата (SrSO4)
- Барий (Ba): может образовывать осадок барий сульфата (BaSO4)
Изучение взаимодействия разбавленных солей с щелочноземельными металлами является важным аспектом в химии и имеет широкое применение в различных областях, от аналитической химии до фармацевтики.
Реактивность магния, кальция и стронция
Магний является химическим элементом из группы щелочноземельных металлов. Он обладает высокой реактивностью и способен быстро вступать в химические реакции. При взаимодействии магния с водой, образуется магний-гидроксид и выделяется водород. Это реакция, которая протекает с выделением тепла и образованием горящего огонька на поверхности металла. Магний также реагирует с кислородом воздуха, образуя оксид магния (MgO). Оксид магния может быть дальше использован в различных отраслях промышленности, например, для производства огнеупорного кирпича и керамики.
Кальций, также принадлежащий к группе щелочноземельных металлов, проявляет среднюю реактивность. Он реагирует с водой подобно магнию, образуя кальций-гидроксид и выделяя водород. Реакция кальция с водой проходит медленнее, чем у магния. Кальций также реагирует с кислородом, но оксид кальция (CaO) обладает менее высокими свойствами огнеупорности по сравнению с оксидом магния, и поэтому его применяют в меньшей степени в промышленности.
Стронций - химический элемент группы щелочноземельных металлов. Реактивность стронция также средняя. При взаимодействии со водой образуется стронций-гидроксид и выделяется водород. Стронций реагирует с кислородом, образуя оксид стронция (SrO), который может вступать в дальнейшие химические реакции, например, с кислотами.
Таким образом, магний, кальций и стронций обладают разной степенью реактивности, что определяет их возможности для использования в различных химических процессах и промышленных отраслях.
Вопрос-ответ

Какие металлы вступают в химическую реакцию с разбавленной солью?
Многие металлы могут вступать в химическую реакцию с разбавленной солью, такие как железо, цинк, медь, никель, свинец и некоторые другие. Однако, способность металлов вступать в химическую реакцию с разбавленными солями зависит от их электрохимического потенциала и других факторов.
Как происходит химическая реакция металлов с разбавленными солями?
При взаимодействии металлов с разбавленными солями происходит окислительно-восстановительная реакция, где металл окисляется, а ион металла в соли восстанавливается. Это происходит за счет передачи электронов от металла к иону металла. В результате такой реакции образуется новое соединение металла.
Какие применения имеют химические реакции металлов с разбавленными солями?
Химические реакции металлов с разбавленными солями имеют различные применения. Например, они могут использоваться в производстве металлических изделий, катодных защитных покрытий, электродов и других изделий. Кроме того, такие реакции находят применение в химическом анализе, исследовании свойств металлов и других областях науки и промышленности.
Каким образом можно ускорить или замедлить реакцию металла со разбавленной солью?
Скорость реакции металла с разбавленной солью можно ускорить, повысив температуру раствора или добавив катализатор. Также можно изменить концентрацию раствора или повысить поверхность металла. Влияние на скорость реакции может оказывать и другие факторы, такие как pH раствора, наличие растворимости металла и другие.
