Металлическая химическая связь – это особый тип химической связи, который образуется между атомами металлов. Хотя металлы составляют только небольшую часть периодической системы элементов, они играют важную роль в химии и нашей повседневной жизни. Металлы отличаются от остальных элементов элементарной твердостью, электропроводностью, теплопроводностью и способностью восстанавливать окисленные соединения.
Одной из важных химических свойств металлов является их способность выступать в качестве восстановителей. Восстановление – это процесс, при котором металл передает электроны другому веществу, уменьшая его окисление. Благодаря своей электронной структуре, металлы обладают легкостью отдавать электроны и образовывать положительные ионы.
Роль металлов в качестве восстановителей находит применение во многих областях. Например, металлы используются в электротехнике и электронике для создания проводников и помощников в электродных реакциях. Они также широко применяются в металлургической промышленности для получения чистых металлов из руды и растворителей. Кроме того, металлы играют важную роль в реакциях окисления-восстановления, которые происходят в органической химии и биохимии, когда необходимо восстановить или окислить органическое соединение.
Металлы, обладая способностью восстанавливаться, являются ценными ингредиентами в химических процессах и технологиях, где требуется эффективная передача электронов и управления окислительно-восстановительными реакциями.
Таким образом, металлы не только обладают особыми химическими свойствами, но и играют важную роль в процессах восстановления, что делает их незаменимыми во многих сферах нашей жизни.
Металлическая химическая связь и химические свойства металлов

Металлическая химическая связь – основной тип химической связи в металлах, обусловленный взаимодействием между атомами металлов и электронами оболочки. В этом типе связи свободно движущиеся электроны создают сеть положительных ионных ядер, благодаря чему образуется плотная, упругая кристаллическая решетка. Подобная связь характерна для всех металлов и является важной особенностью их химических свойств.
Металлы обладают рядом химических свойств, которые обусловлены их специфической электронной структурой. Одним из основных свойств металлов является их способность проводить тепло и электричество. Это связано с наличием свободно движущихся электронов в металлической решетке, которые могут свободно перемещаться и передавать энергию или электрический ток.
Металлы также обладают высокой механической прочностью и пластичностью. Их атомы могут перемещаться относительно друг друга без полного разрушения металлической решетки. Это позволяет металлам быть деформируемыми, что является важным свойством для их применения в различных областях, таких как строительство, авиационная и автомобильная промышленность, электроника и другие.
Металлы также проявляют способность вступать в химические реакции, образуя соединения с неметаллами или другими металлами. Они могут взаимодействовать с кислородом, образуя металлические оксиды. Некоторые металлы, такие как железо, способны окисляться под воздействием влаги и кислорода, что приводит к образованию ржавчины.
В заключение, металлическая химическая связь и химические свойства металлов играют важную роль в их природе и применении. Они обусловливают их физические, механические и химические характеристики, делая металлы одними из самых важных материалов в различных сферах деятельности человека.
Роль металлов в качестве восстановителей

Металлы играют важную роль в химических реакциях восстановления, где они действуют в качестве восстановителей. Восстановительная способность металлов обусловлена их электрохимическими свойствами, так как они обладают низкими электроотрицательностями и имеют относительно слабое удержание своих электронов.
Металлы способны отдавать электроны другим веществам, при этом сами превращаясь в положительно заряженные ионы. Это делает их эффективными восстановителями для окислительных реакций. Металлы могут вступать в реакцию с окислителями, принимая их электроны и возращаясь к своему исходному состоянию.
Восстановление металлами может происходить в различных химических процессах. Например, металлы могут восстанавливать окислители в органических реакциях, а также участвовать в электрохимических реакциях, таких как гальванические элементы и электролиз.
Восстановительные свойства металлов являются одной из причин их широкого использования в различных отраслях промышленности и технологии. Металлы, такие как железо, алюминий и цинк, используются для производства стали, алюминиевых сплавов и цинковых покрытий, которые обеспечивают защиту от коррозии и повышают прочность материалов.
Также, использование металлов в качестве восстановителей играет важную роль в природных процессах. Например, ферменты, содержащие ионы металлов, участвуют в метаболических процессах живых организмов, включая дыхание и фотосинтез. Металлы также имеют важное значение в пищевой промышленности, где они используются в качестве добавок и катализаторов для улучшения вкусовых и химических свойств продуктов питания.
Химические свойства металлов: возможность образования солей
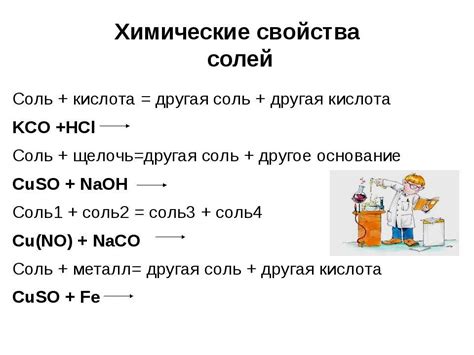
Металлы обладают особыми химическими свойствами, которые определяют их способность образовывать соли. Они имеют высокую электропроводность благодаря свободным электронам в своей валентной оболочке, что позволяет им эффективно взаимодействовать с другими химическими элементами.
Важным химическим свойством металлов является их способность вступать в химические реакции с кислотами и образовывать соли. Когда металл взаимодействует с кислотой, происходит обмен ионами: кислотные ионы отдают свои водородные катионы металлу, а металлические ионы передают свои электроны кислороду или окислителю. В результате образуется соль и обуславливается окислительно-восстановительное действие металла.
Образование солей позволяет металлам играть важную роль в различных химических процессах и реакциях. Например, соли металлов используются в медицине, пищевой промышленности, сельском хозяйстве и многих других отраслях. Они служат строительным материалом для создания прочных конструкций, а также используются в процессах очистки и получения электроэнергии.
Металлы имеют различные свойства, которые определяют их способность образовывать соли. Эти свойства включают в себя степень восстановительной активности, реакционную способность и электропроводность. Например, некоторые металлы, такие как натрий и калий, обладают высокой активностью и легко реагируют с кислотами, образуя соли. А другие металлы, такие как золото и платина, менее активны и образуют сложные соли с более высокими окислительными состояниями.
Металлическая химическая связь: основные характеристики
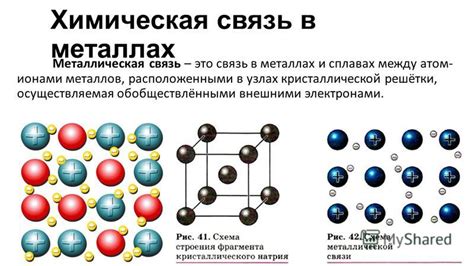
Металлическая химическая связь представляет собой особую форму химической связи, характерную для металлов. Она образуется между атомами металлов и имеет ряд основных характеристик.
Первая характеристика металлической связи - делимость металлических кристаллов. Металлы обладают так называемой металлической структурой, которая представляет собой кристаллическую решетку из положительно заряженных ядер атомов металла, окруженных облаком свободно движущихся электронов. Данная структура обеспечивает высокую делимость металлических кристаллов, что является одной из основных характеристик металлической связи.
Вторая характеристика - высокая проводимость тепла и электрического тока. Металлическая связь обладает высокой подвижностью электронов, что обусловливает хорошую электрическую и теплопроводность металлов. Электроны свободно переносят электрический заряд и тепло, что позволяет металлам быть отличными проводниками электричества и тепла.
Третья характеристика - пластичность и формоизменяемость металлов. Благодаря особой структуре и металлической связи, металлы обладают высокой пластичностью и способностью изменять свою форму без разрушения. Это свойство позволяет металлам быть идеальными материалами для различных видов обработки, включая литье, прокатку, штамповку и тянение.
Четвертая характеристика - металлическая связь обуславливает способность металлов к образованию сплавов. Металлы могут образовывать сплавы с другими металлами и неметаллическими элементами, что расширяет их свойства и позволяет создавать материалы с нужными характеристиками для различных областей применения.
Взаимодействие металлов и неметаллов: процесс окисления

Окисление – это процесс химической реакции, при которой металлы вступают в реакцию с неметаллами, в результате которой металлы теряют электроны и приобретают положительный заряд. В таких реакциях металлы действуют в качестве восстановителей, а неметаллы – в качестве окислителей.
В процессе окисления металлы переходят из формы нейтральных атомов с нулевым зарядом в форму положительно заряженных ионов. Это происходит из-за передачи электронов от металлов к неметаллам, что обусловлено разницей электроотрицательностей между ними.
Процесс окисления является основой для множества химических реакций. Взаимодействие металлов и неметаллов может приводить к образованию соединений, таких как оксиды, хлориды, сульфиды и другие. Например, реакция окисления натрия с хлором приводит к образованию натрия хлорида:
- 2Na + Cl2 → 2NaCl
Металлическая химическая связь позволяет металлам обладать высокой электропроводностью и теплопроводностью, а также обеспечивает им перенос электронов и ионных зарядов при окислительно-восстановительных реакциях.
Роль металлов в экологии и промышленности

Металлы играют важную роль в экологии и промышленности. Они являются неотъемлемой частью многих процессов и имеют разнообразные применения.
В экологии металлы выполняют ряд функций. Некоторые металлы, такие как железо и медь, необходимы для нормального функционирования организмов. Они являются важными компонентами ферментов и других белковых структур. Кроме того, металлы могут служить катализаторами в различных биохимических реакциях.
В промышленности металлы широко используются для производства различных изделий. Например, железо и сталь применяются в строительстве, машиностроении и автомобильной промышленности. Алюминий используется для производства упаковочного материала, каким является, к примеру, алюминиевая фольга. Олово находит применение в производстве электроники, так как обладает хорошими электрическими свойствами.
Кроме того, металлы могут быть использованы в процессах восстановления. Например, цинк используется при гальваническом покрытии, что позволяет защитить детали от коррозии. Также некоторые металлы, такие как алюминий, могут быть восстановлены из руды и использоваться повторно, что способствует эффективному использованию природных ресурсов.
Вопрос-ответ

Какие химические свойства металлов связаны с их ролью восстановителей?
Химические свойства металлов, связанные с их ролью восстановителей, включают высокую активность в реакциях окисления-восстановления, способность отдавать электроны, образование положительных ионов и проводимость электричества.
Почему металлы отдают электроны при окислении?
Металлы отдают электроны при окислении из-за того, что их электронная структура характеризуется наличием недостатка электронов во внешнем энергетическом уровне. Отдача электронов позволяет металлам достичь более устойчивой электронной конфигурации.
