Металлы являются одним из основных классов веществ, которые обладают уникальными свойствами и широко применяются в различных отраслях промышленности и научных исследованиях. Одно из главных свойств металлов - это возможность образования металлической связи, которая является основой для их характеристических физических и химических свойств.
Металлическая связь возникает в металлах благодаря особенностям строения и взаимодействия их атомов. Атомы металлов обладают свободными электронами в своей валентной оболочке, которые могут двигаться и образовывать общие электронные облака с атомами соседних металлов. Это явление, называемое «электронное облако», позволяет электронам свободно передвигаться в общей для всех атомов металла электронной оболочке.
Благодаря возможности перехода свободных электронов от одного атома к другому, образуется сильная и устойчивая металлическая связь. Значительная подвижность электронов в общей электронной оболочке металла позволяет им эффективно проводить электрический ток и тепло, а также обеспечивает металлам высокую пластичность и прочность.
Механизмы металлической связи

Металлическая связь является основной формой связи между атомами в металлах. Она обеспечивает устойчивость металлической решетки и определяет их физические и химические свойства.
Основной механизм металлической связи заключается в обмене электронами между атомами металла. В металлической связи электроны делокализованы, то есть они свободно перемещаются по всей металлической решетке. Это обуславливает хорошую электропроводность металлов.
Другой механизм металлической связи связан с сильным взаимодействием между атомами металла и ядрами. В металлах атомы находятся близко друг к другу и создают плотную упаковку. Это позволяет эффективно передавать силы, что обуславливает высокую прочность металлов.
Также существует механизм металлической связи, основанный на обмене электрическими полями. В металлической решетке атомы металла обладают полярностью, что приводит к возникновению притяжения между ними. Этот механизм также способствует установлению металлической связи.
- Обмен электронами
- Сильное взаимодействие атомов и ядер
- Обмен электрическими полями
Ионные взаимодействия между атомами

Ионные взаимодействия являются одним из основных механизмов образования металлической связи в соединениях металлов. Они возникают между атомами, принадлежащими разным элементам, и обусловлены перераспределением электронов.
В процессе ионизации один атом отдает один или несколько электронов другому атому, при этом образуются положительно и отрицательно заряженные ионы. Положительные ионы называются катионами, а отрицательные – анионами.
Ионные взаимодействия обладают высокой прочностью и устойчивостью. Они характеризуются высокими температурами плавления и кипения, а также обладают хорошей теплопроводностью и электропроводностью.
Помимо ионных взаимодействий, в металлах также могут присутствовать и другие типы связей, такие как металлические и ковалентные. Металлическая связь возникает между атомами металла и характеризуется общими для всех металлов свойствами, такими как пластичность и гибкость. Ковалентная связь, в свою очередь, основана на обмене электронами и характерна для соединений неметаллов.
Образование кристаллической решетки
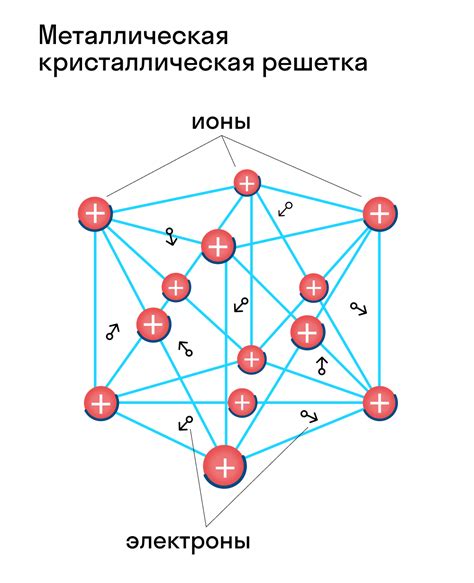
Металлическая связь, основанная на образовании кристаллической решетки, является характерной для металлов. Кристаллическая решетка представляет собой упорядоченную структуру, в которой атомы металла занимают определенные позиции и взаимодействуют между собой.
Образование кристаллической решетки начинается с расположения атомов металла в трехмерной сетке. Атомы занимают узлы этой сетки, образуя кристаллическую решетку. Расположение атомов в решетке обеспечивает слабое притяжение между ними, что обуславливает характерную для металлов высокую пластичность и проводимость.
Атомы металла в кристаллической решетке объединяются межатомными связями, которые образуются за счет обмена электронами. В металлах электроны внешней оболочки обладают свободной подвижностью, что обеспечивает проводимость электрического тока. Это связано с образованием так называемой "электронной облакности", которая пронизывает всю кристаллическую решетку металла и формирует его свойства.
В результате образования кристаллической решетки металлов происходит укладка атомов по определенному порядку, что создает характерные металлические свойства, такие как пластичность, теплопроводность и проводимость электрического тока.
Роль валентных электронов
Валентные электроны играют ключевую роль в формировании металлической связи в соединениях металлов. Эти электроны находятся на самом внешнем энергетическом уровне атома и свободно двигаются между атомами в металлической структуре.
Валентные электроны обладают особыми свойствами, позволяющими им участвовать в образовании металлической связи. Они обладают высокой подвижностью и могут передвигаться по всей структуре металла. Это является основной причиной того, что металлы являются хорошими проводниками электричества и тепла.
Количество валентных электронов в атоме металла определяет его химические свойства. Чем больше валентных электронов у металла, тем больше энергии он обладает и тем больше у него способностей к образованию металлической связи. Это также влияет на его плотность и теплопроводность.
Итак, валентные электроны являются основными участниками металлической связи. Они обеспечивают свободное движение электронов и формируют структуру, которая обладает металлическими свойствами. Благодаря уникальным свойствам валентных электронов металлы являются важными материалами в различных областях науки и техники.
Моделирование металлической связи

Металлическая связь является одной из основных типов химических связей в металлах. Для изучения и моделирования данного явления используются различные теоретические и экспериментальные методы.
Одной из основных теорий моделирования металлической связи является электронно-газовая модель. Она предлагает представление металлической структуры в виде положительного иона металла, окруженного электронным облаком, которое можно рассматривать как электронный газ.
Другой распространенной моделью является теория свободных электронов. Она предполагает, что электроны металла свободно движутся внутри кристаллической решетки и не связаны с конкретными атомами. Эта модель помогает объяснить характеристики металлов, такие как электропроводность и теплопроводность.
Моделирование металлической связи также может проводиться с помощью квантово-механических расчетов. Такие расчеты позволяют получить информацию о распределении электронной плотности в металле, характере его связей и энергетических уровнях.
Таким образом, моделирование металлической связи является важным инструментом для понимания и исследования свойств металлов. Оно позволяет получить представление о структуре и поведении металлов на микро- и макроуровне, а также способствует разработке новых материалов с желаемыми свойствами.
Физические свойства металлов
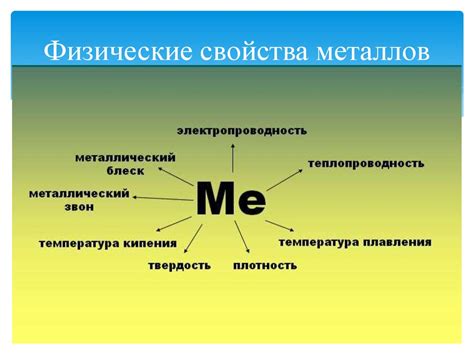
Проводимость электричества и тепла. Одним из основных физических свойств металлов является их высокая проводимость как электричества, так и тепла. Это объясняется наличием свободных электронов в структуре металлической решетки. Электроны могут свободно перемещаться по материалу, что обуславливает возможность электрической и тепловой проводимости.
Высокая пластичность и проволочность. Металлы отличаются способностью к деформации без разрушения. Они могут быть легко раскатаны в тонкие листы или вытянуты в тонкие проволоки. Это объясняется особенностями атомной структуры металлических соединений, в которых атомы образуют плотную упаковку и имеют слабую взаимодействия.
Металлический блеск. Большинство металлов имеют характерный блеск, который называется металлическим или металлическим блеском. Это связано с оптическими свойствами металлической решетки и возможностью свободного проникновения света.
Высокая плотность. Металлы обладают высокой плотностью, то есть имеют большую массу в единице объема. Это связано с плотной упаковкой атомов в металлической решетке. Из-за высокой плотности металлы обычно тяжелы и могут быть использованы для различных технических и строительных целей.
Высокая температура плавления. Большинство металлов обладают высокой температурой плавления, что делает их полезными материалами для применения в высокотемпературных процессах и изделиях. Высокая температура плавления объясняется сильными атомными связями в металлической решетке, которые требуют большого количества энергии для разрушения и перехода в жидкое состояние.
Применение металлической связи в промышленности
Металлическая связь – один из наиболее важных и широко используемых типов химической связи в промышленности. Она обусловлена особенностями строения металлических соединений и является основой для получения металлических материалов.
Одним из основных применений металлической связи в промышленности является производство металлов и сплавов. Металлическая связь позволяет образовывать кристаллическую решетку, в которой атомы металла связаны между собой общими электронами. Это придает металлам и сплавам их характерные физические и химические свойства, такие как высокая теплопроводность, электропроводность и пластичность.
Кроме того, металлическая связь находит применение в процессах электрохимии. Например, в процессе электролиза атомы металла освобождаются от растворенных ионов и осаждаются на электроде, что позволяет получать чистый металл. Также металлическая связь используется при производстве гальванических покрытий, где на поверхность детали осаждается тонкий слой металла для защиты от коррозии или для придания декоративных свойств.
Еще одним важным применением металлической связи в промышленности является производство проводников электричества. Благодаря особенностям металлической связи, металлы обладают высокой электропроводностью, что делает их идеальным материалом для изготовления проводов и кабелей. Также металлическая связь позволяет создавать электрические контакты, которые обеспечивают надежное соединение металлических деталей в электронике и электротехнике.
Особенности металлической связи в различных металлах

Металлическая связь является основной типом химической связи, которая образуется между атомами в металлах. Ее особенность заключается в том, что электроны в металлическом кристалле перемещаются свободно по всей его структуре. Однако, металлическая связь может иметь некоторые особенности в зависимости от типа металла.
- Атомные металлы: Характерной особенностью металлической связи в атомных металлах является регулярное упорядочение кристаллической структуры. Металлы такого типа имеют отдельные атомы, которые тесно связаны друг с другом благодаря общей сетке атомов. Подобное упорядочение обеспечивает высокую прочность материала.
- Металлы с атомами недопустимой валентности: В некоторых металлах, таких как железо и марганец, атомы имеют переменную валентность. Это означает, что атомы таких металлов могут иметь различное число валентных электронов в своей внешней оболочке. Это влияет на степень связи между атомами, что приводит к различным электрофизическим свойствам этих металлов.
- Сплавы: В металлических сплавах, как правило, встречаются различные металлы. При образовании металлической связи в сплавах происходит смешивание электронов от металлов, что создает новый тип связи. Особенности металлической связи в сплавах определяются химическим составом и пропорциями различных металлов. Это позволяет создавать сплавы с различными химическими и физическими свойствами.
Таким образом, металлическая связь в различных типах металлов может иметь свои особенности, связанные с кристаллической структурой, валентностью атомов и химическим составом сплава. Эти особенности влияют на физические и химические свойства металлов, делая их уникальными и применимыми в различных областях промышленности и науки.
Вопрос-ответ

Как возникает металлическая связь?
Металлическая связь возникает благодаря электронам проводимости, которые образуют электронный облако в металле. Электроны проводимости свободно движутся по всему объему металла, создавая металлическую связь между атомами.
Какие факторы влияют на возникновение металлической связи?
Факторы, влияющие на возникновение металлической связи, включают: размеры атомов металла, их заряд, наличие свободных электронов проводимости, и структура кристаллической решетки металла.
Какие свойства обусловлены металлической связью?
Металлическая связь обусловливает такие свойства металлов как проводимость электричества и тепла, пластичность и формоизменяемость, блеск и отсутствие прозрачности, хорошую термостойкость и высокую жаропрочность.
Можно ли проводить сравнение металлической связи с другими видами химических связей?
Да, металлическая связь можно сравнить с ионной и ковалентной связью. В отличие от ионной связи, где электроны переходят от одного атома к другому, в металлической связи электроны общей проводимости свободно движутся по всему объему металла. В отличие от ковалентной связи, где электроны заняты валентными электронными облаками, в металлической связи электроны между атомами распределены равномерно и свободно движутся в общем электронном облаке.
