Химические элементы нашей планеты можно разделить на две большие группы — металлы и неметаллы. Это деление находит свое применение в различных областях науки и техники. Одной из основных характеристик металлов и неметаллов является их способность окисляться или восстанавливаться.
Металлы, как правило, обладают способностью окисляться, то есть принимать электроны от других веществ, выступая в реакции в качестве окислителя. Они образуют положительно заряженные ионы, способные легко отдавать электроны и образовывать положительные ионы. Примером может служить железо, которое взаимодействуя с кислородом, образует железную ржавчину.
Неметаллы, наоборот, демонстрируют способность восстанавливаться, то есть отдавать электроны и выступать в реакциях в качестве восстановителя. Они образуют отрицательно заряженные ионы, способные легко принимать электроны и образовывать отрицательные ионы. Примером может служить кислород, который взаимодействуя с металлами, образует оксиды.
Металлы и неметаллы встречаются во всем окружающем нас мире и составляют основу многих веществ. Их способность окисляться или восстанавливаться является основой многих химических реакций и процессов, которые происходят как на микроуровне, так и на макроуровне.
Роль металла и неметалла в окислительно-восстановительных реакциях

В химии окислительно-восстановительные реакции играют важную роль, позволяя происходить переносу электронов между веществами. Для того чтобы произошла реакция, необходимы два участника: окислитель и восстановитель. Металлы и неметаллы могут выполнять роль как окислителя, так и восстановителя в таких реакциях.
Металлы обладают свойствами проводить электрический ток и часто встречаются в качестве окислителя. Они способны отдавать электроны и окисляться, что позволяет другому веществу принять эти электроны и восстановиться. Металлы, как окислители, вступают в реакцию с неметаллами, образуя ионы и осаждаясь на поверхности вещества, выступающего в качестве восстановителя.
Неметаллы, наоборот, обладают свойствами принимать электроны и выступать в роли восстановителя. Они могут вступать в реакции с металлами, принимая от них электроны и снижая свою окислительность. Таким образом, неметаллы окисляются, и металлы восстанавливаются в процессе окислительно-восстановительных реакций.
Знание роли металлов и неметаллов в окислительно-восстановительных реакциях позволяет более глубоко понять принципы химических процессов и применять их в различных областях, таких как электрохимия, металлургия, производство химических веществ и других.
Металл как окислитель
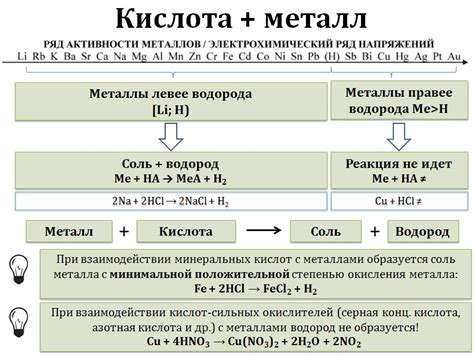
Металлы, в отличие от неметаллов, способны выступать как окислители, то есть отдавать электроны. Это связано с особенностью электронной структуры металлов: у них есть свободные или слабосвязанные электроны во внешней энергетической оболочке. При контакте металла с неметаллом, электроны из оболочки металла могут передаваться неметаллу, что ведет к окислению металла.
Окисление металла происходит при взаимодействии его с оксидантом, который обладает высокой электроотрицательностью и способен принимать электроны. Примером окислителя может служить хлор, кислород или кислородсодержащие соединения. При контакте металла с окислителем происходит перенос электронов с металла на окислитель, что в результате приводит к окислению металла.
Оксид металла, образующийся при окислении, часто выступает в виде нерастворимого вещества, образуя пленку на поверхности металла, которая защищает его от дальнейшего окисления. Примером такой пленки может служить патина на поверхности меди или корка на поверхности железа. В некоторых случаях окисление может приводить к разрушению материала, особенно если оксидообразующий процесс протекает с выделением тепла.
Металлы, выступая как окислители, являются важными участниками химических реакций и растворяются в некоторых кислотах с образованием солей, сопровождаемых выделением водорода. Это свойство металлов можно использовать, например, при очистке воды от загрязнений, а также в процессе гальванического покрытия металлами.
Неметалл как восстановитель

Неметаллы могут выступать в химических реакциях как восстановители благодаря своей высокой электроотрицательности и способности принимать электроны от других элементов. В процессе окислительно-восстановительных реакций неметаллы передают электроны металлам или полуметаллам, в результате чего сами становятся оксидами или ионами.
Неметаллы, такие как сера, фосфор, хлор, бром и йод, активно взаимодействуют с металлами, образуя ионные соединения. Например, сера при контакте с металлами образует сульфиды. Это объясняется тем, что неметаллы обладают низкой ионизационной энергией, что позволяет им легко принимать электроны и становиться оксидированными.
Неметаллы также могут вступать в реакции с металлическими оксидами, восстанавливая их и образуя неметаллические оксиды. Например, кислород, как неметалл, обладает способностью окислять металлические оксиды, превращая их в неметаллические оксиды. Это можно наблюдать в процессе горения или взрыва, где кислород служит восстановителем, образуя оксид кислорода.
Важно отметить, что способность неметаллов выступать в химических реакциях как восстановители зависит от их электроотрицательности и энергетических свойств. Более электроотрицательные неметаллы имеют большую способность принимать электроны и вступать в реакции восстановления. Это свойство неметаллов широко используется в различных промышленных и научных процессах.
Химические реакции между металлами и неметаллами
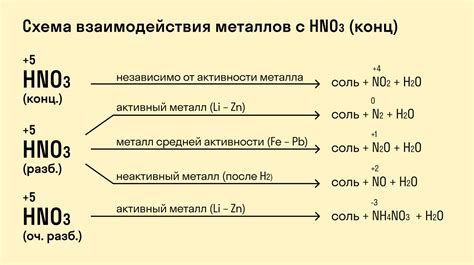
Химические реакции между металлами и неметаллами являются основой многих процессов в природе и промышленности. В результате взаимодействия металла и неметалла могут образовываться различные соединения, такие как соли, оксиды или гидриды.
Металлы обладают высокой реакционной способностью и обычно действуют как окислители. Они способны отдавать электроны, что позволяет неметаллам, выступающим в роли восстановителей, получать электроны и образовывать соединения с металлами.
Такие реакции являются экзотермическими, то есть сопровождаются выделением тепла. Например, реакция горения металлов, где кислород (неметалл) взаимодействует с металлом, является хорошо известным примером химической реакции между металлом и неметаллом. В результате горения образуется оксид металла и выделяется тепло и свет.
Некоторые металлы могут вступать в реакцию с неметаллами не только при пониженных, но и при повышенных температурах. Например, реакция алюминия и хлора происходит при повышенных температурах и образует хлорид алюминия.
Важно отметить, что химические реакции между металлами и неметаллами могут быть различными. Одни металлы могут образовывать соединения с несколькими неметаллами, другие - только с определенным неметаллом. Также реакции между металлами и неметаллами могут происходить в разных условиях и требовать наличия катализаторов.
Виды окислительно-восстановительных реакций

Окислительно-восстановительные реакции являются важным классом химических реакций, которые происходят с участием окислителей и восстановителей. В зависимости от типа веществ, которые вступают в реакцию, можно выделить несколько видов таких реакций.
Одним из видов окислительно-восстановительных реакций является реакция окисления металлов. В данном случае, металл является восстановителем, а окислитель - неметалл или его соединения. Например, реакция железа с кислородом, при которой железо окисляется, а кислород восстанавливается.
Еще одним видом окислительно-восстановительных реакций является реакция сгорания органических веществ. В этом случае, оксидантом является кислород, а органическое вещество - восстановителем. Например, при горении углеводородов, оксидантом выступает кислород из воздуха, а углерод и водород из углеводородов - восстановители.
Также существуют окислительно-восстановительные реакции, в которых оксидантом выступает одно вещество, а восстановителем - другое. К таким реакциям относится реакция цинка с серной кислотой, где цинк является восстановителем, а серная кислота - оксидантом.
Виды окислительно-восстановительных реакций можно классифицировать также по изменению степени окисления атомов веществ, вступающих в реакцию. Например, реакция, в которой одно вещество окисляется, а другое восстанавливается, называется одновременной окислительно-восстановительной реакцией.
Таким образом, окислительно-восстановительные реакции представляют собой разнообразные процессы, происходящие между окислителями и восстановителями, и играют важную роль во многих химических и жизненных процессах.
Влияние металлов и неметаллов на окружающую среду

Металлы, будучи окислителями, оказывают влияние на окружающую среду в виде загрязнения воды, почвы и атмосферы. Выбросы металлов в атмосферу, такие как свинец и ртуть, могут привести к серьезным проблемам здоровья человека и животных.
Одним из самых негативных воздействий металлов на окружающую среду является выбросы в воду. Металлы, такие как ртуть и кадмий, могут накапливаться в озерах, реках и морях, что приводит к отравлению водных организмов и деградации экосистемы в целом.
С другой стороны, неметаллы, являющиеся восстановителями, имеют свое влияние на окружающую среду. Например, сера, являющаяся неметаллом, содержится в ряде топлив, которые сжигаются в процессе, выделяя сернистый газ в атмосферу. Это приводит к образованию кислотных дождей, которые оказывают разрушительное воздействие на леса и водные ресурсы.
Также неметаллы негативно влияют на почву. Например, азотные соединения, образующиеся при использовании пестицидов, угрожают плодородию почвы и могут приводить к эрозии. Кроме того, эти соединения могут перемещаться с поверхности почвы в грунтовые воды, что приводит к их загрязнению.
Более того, составные элементы, такие как фосфор и калий, которые относятся к неметаллам, широко используются в сельском хозяйстве и могут контаминировать водные ресурсы при сливе смывных вод и удобрений в реки или озера. Они вызывают проблемы с экосистемами и нарушают баланс водных организмов.
Применение металлов как окислителей

Металлы имеют широкое применение в химических процессах, где выступают в качестве окислителей. Окислитель — вещество, участвующее в реакции окисления, при которой оно само снижает свою степень окисления.
Металлы отличаются от неметаллов своей способностью отдавать электроны. Благодаря этому свойству они являются эффективными окислителями. Одним из наиболее распространенных металлов-окислителей является кислород. Он наиболее активный элемент из группы неметаллов и широко применяется в реакциях окисления.
Окисление металлами является важным процессом в промышленности. Например, углерод окисляется в присутствии железа, что позволяет получить серную кислоту. Также, в медицинской сфере металлы-окислители используются при получении лекарственных препаратов.
В реакциях окисления металлы способны изменять свою степень окисления. Например, двух- и трехвалентные формы металла могут переходить друг в друга в зависимости от условий окружающей среды. Это свойство металлов является важным при их применении в качестве окислителей.
Таким образом, металлы играют важную роль в химических процессах в качестве окислителей. Их способность отдавать электроны делает их эффективными взаимодействующими веществами и позволяет осуществлять различные промышленные и медицинские процессы.
Применение неметаллов как восстановителей

Неметаллы, в отличие от металлов, обладают способностью вступать в химические реакции восстановления. Восстановление – это процесс передачи электронов от вещества, называемого восстановителем, к веществу, называемому окислителем.
Окисление и восстановление часто происходят параллельно и неотделимы друг от друга. Неметаллы, выступая в реакциях восстановления в качестве восстановителей, проявляют высокую способность усваивать электроны от веществ с более высоким потенциалом окисления.
Применение неметаллов в качестве восстановителей имеет широкий спектр применений. Например, в области производства электроники неметаллы, такие как кремний и германий, используются для создания полупроводниковых приборов. В процессе восстановления неметаллы выступают в роли активных элементов, которые способны эффективно проводить электрический ток.
Неметаллы также используются в качестве восстановителей в химической промышленности. Например, в процессе производства хлора неметаллы, такие как водород и сероводород, используются в качестве восстановителей при электролизе хлорида натрия. Эти неметаллы обладают сильными восстановительными свойствами и способны эффективно реагировать с окислителем на аноде электролизера.
Кроме того, неметаллы используются в металлургии для улавливания примесей и вредных элементов в металлах. Например, фосфор выступает в роли восстановителя при улавливании серы и фосфора из железных руд. Фосфор образует соединения с этими вредными элементами и образуется шлак, который можно удалить из металла.
Вопрос-ответ

Можете объяснить, что такое окислитель и восстановитель?
Окислитель - это вещество, которое способно получать электроны от других веществ, теряя при этом свои собственные. Восстановитель - это вещество, которое способно передавать электроны другим веществам, приобретая при этом новые.
Почему металлы являются окислителями, а неметаллы - восстановителями?
Металлы имеют низкую электроотрицательность и легко отделяют электроны, поэтому они имеют склонность становиться окислителями. Неметаллы, наоборот, имеют высокую электроотрицательность, поэтому они получают электроны от других веществ и выступают в роли восстановителей.
Какой пример можно привести для иллюстрации процесса окисления-восстановления?
Примером может быть реакция горения металла в кислороде. Например, при сгорании магния его атомы окисляются, отдавая электроны, а молекулы кислорода восстанавливаются, получая электроны от металла.
