Металлы, будучи ионами в растворе, могут быть восстановлены путем электролиза. Один из простых способов восстановления металла - использование кислотного раствора. Электролиз раствора кислоты позволяет совершать аккуратный и контролируемый процесс восстановления металла.
Во время электролиза раствора кислоты, анод и катод занимают различные роли. Анод - положительно заряженный электрод, который расположен на одном конце электролитической ячейки. Катод – отрицательно заряженный электрод, находящийся на другом конце ячейки. Роль этих электродов в электролизе кислотного раствора заключается в том, чтобы металл из раствора перешел на поверхность катода, следуя за током электролиза.
Процесс восстановления металла при электролизе кислотного раствора является эффективным способом очистки и извлечения металла из его соединений. Он применяется в различных областях, таких как производство металлов, промышленность, электроника и другие. Этот процесс играет важную роль в обеспечении металлургической промышленности и является неотъемлемой частью современных технологий.
Как восстановить металл при помощи электролиза кислотного раствора

Электролиз кислотного раствора является одним из эффективных методов восстановления металла. В процессе электролиза металл, находящийся в растворе кислоты, подвергается электрическому разложению, в результате чего происходит его восстановление. Электролиз позволяет восстанавливать металлы даже в тех случаях, когда они находятся в сложных соединениях или имеют оксидные примеси.
Для проведения электролиза кислотного раствора необходимо использовать специальное оборудование. В центре установки находится электролитическая ячейка, в которую помещается раствор кислоты с металлическим электродом. Важно установить правильную полярность электродов – положительный электрод должен быть подключен к аноду, а отрицательный – к катоду. Таким образом, происходит отделение с металла положительно заряженных ионов, которые переносятся на катод и оседают в виде металлического отложения.
Для достижения наилучших результатов необходимо выбрать подходящий кислотный раствор, подобрать оптимальные значения температуры, концентрации кислоты и плотности тока электролиза. Также важно учитывать особенности металла, который требуется восстановить, такие как его растворимость, температура плавления и степень окисления. Электролиз кислотного раствора является процессом, который требует тщательного контроля и постоянного мониторинга, чтобы добиться желаемого результата.
Восстановление металла при помощи электролиза кислотного раствора является важной технологией в металлургической и химической промышленности. Она позволяет получать высококачественные металлические отложения, восстанавливать ценные металлы из руд и отходов производства. Кроме того, данный метод может использоваться и в научных исследованиях для изучения свойств металлов и процессов их восстановления.
Принципы восстановления металла электролизом
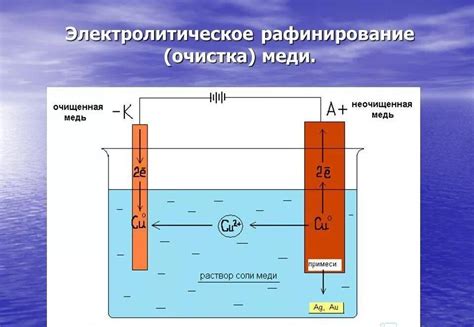
Электролиз является процессом восстановления металла при воздействии электрического тока на раствор кислоты. Восстановление происходит благодаря протеканию электролизных реакций на электродах. При этом положительный ток, подводимый к катоду, позволяет металлу принимать электроны и образовать ион, а отрицательный ток, подводимый к аноду, индуцирует окисление воды или ионов кислоты. Таким образом, металл восстанавливается на катоде, а вода или кислота окисляются на аноде.
Электролиз основывается на принципе электростатической силы, которая действует во время проведения тока через электролитическую ячейку. Ионизованные атомы металла перемещаются к катоду под влиянием электрического поля и принимают на себя электроны для восстановления. В результате этого процесса металл осаждается на поверхности катода в виде металлического осадка.
Важно отметить, что электролиз может быть эффективен только при наличии проводящего раствора кислоты. Этот раствор содержит ионы металла, которые могут перемещаться в присутствии электрического поля. Кроме того, электролиз также требует наличия двух электродов - катода и анода - для создания электрической цепи.
Процесс восстановления металла электролизом имеет широкое применение в различных областях, включая производство металлических изделий, очистку воды и металлургию. Он позволяет эффективно восстанавливать и использовать металлы, что значительно сокращает необходимость в добыче новых ресурсов и имеет положительное влияние на окружающую среду.
Выбор кислотного раствора для электролиза
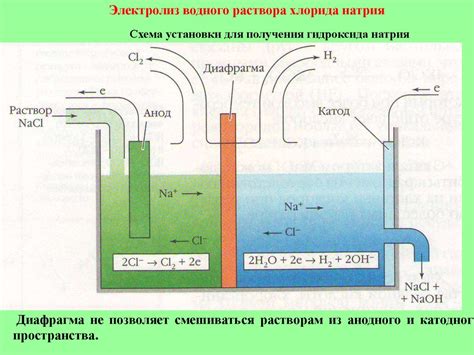
При проведении электролиза раствора кислоты для восстановления металла необходимо выбирать соответствующий кислотный раствор. Этот выбор зависит от нескольких факторов, включая химическую активность кислоты, тип металла, его концентрацию и желаемый результат процесса.
Химическая активность кислоты играет ключевую роль в выборе кислотного раствора для электролиза. Активная кислота обеспечивает более интенсивный процесс электролиза и быстрое восстановление металла. Следует учитывать, что слишком активная кислота может вызвать нежелательные химические реакции или коррозию электродов.
Тип металла также важен при выборе кислотного раствора. Некоторые металлы могут быть восстановлены только в определенных кислотных средах. Например, железо обычно восстанавливается в серной кислоте, а медь – в соляной кислоте. Проведение электролиза в несоответствующем кислотном растворе может привести к неполной реакции или даже к невозможности восстановления металла.
Концентрация кислотного раствора также имеет значительное значение. Высокая концентрация может способствовать более эффективному электролизу, однако слишком высокая концентрация может вызвать реакции, противодействующие восстановлению металла. Наоборот, низкая концентрация может замедлить процесс электролиза.
Желаемый результат электролиза также влияет на выбор кислотного раствора. Если требуется получить чистый металл, то следует выбирать наиболее подходящую кислоту. Если же требуется получить соединение или комплекс металла с другими веществами, то выбор кислоты будет иной.
В целом, выбор кислотного раствора для электролиза зависит от нескольких факторов, включая химическую активность кислоты, тип металла, его концентрацию и желаемый результат. Каждая ситуация требует индивидуального подхода и тщательного анализа, чтобы обеспечить эффективный электролиз и восстановление металла.
Основные этапы электролиза раствора кислоты для восстановления металла

Электролиз раствора кислоты для восстановления металла – это процесс, который происходит в несколько этапов. Прежде всего, необходимо подготовить рабочий электрод, который будет восстанавливать металл. Вторым этапом является подготовка электролита – раствора кислоты. Он должен быть правильно разведен и иметь определенную концентрацию, чтобы обеспечить эффективное проведение процесса.
После этого начинается процесс электролиза, который состоит из нескольких основных этапов. Первый этап – это анодный процесс, когда на аноде происходит окисление и уход электронов. Образуется кислород, который может присутствовать в виде газа или окисленных частиц. Второй этап – это катодный процесс, когда металл восстанавливается на поверхности катода. Восстановление металла происходит за счет поступления электронов на поверхность катода и их реакции с ионами металла из раствора.
Важным этапом в процессе электролиза является контроль параметров, таких как температура, напряжение, время и концентрация раствора. Они должны быть оптимальными для эффективной и точной восстановления металла. Также необходимо учитывать плотность электродов, чтобы обеспечить равномерное распределение электронов и ионов металла на поверхностях анода и катода.
В результате электролиза раствора кислоты для восстановления металла, последний получает свою первоначальную форму и структуру. Этот процесс имеет широкое применение в различных отраслях промышленности, таких как металлургия, электроника, химическая промышленность и другие.
Применение восстановленного металла

Восстановленный металл, полученный при электролизе раствора кислоты, имеет широкое применение в различных сферах.
Например, восстановленный металл может использоваться в производстве электроники. Он может быть использован для создания проводников, контактов и различных компонентов в электрических цепях. Восстановленный металл обладает высокой электропроводностью и стабильностью, что позволяет использовать его в различных электронных устройствах.
Кроме того, восстановленный металл может быть использован в производстве металлических изделий. Он может служить основой для создания различных металлических конструкций, изделий и деталей. Восстановленный металл прочен и устойчив к коррозии, что делает его идеальным материалом для использования в таких областях, как машиностроение, авиационная промышленность и строительство.
Еще одним примером применения восстановленного металла является его использование в производстве аккумуляторов. Восстановленный металл может служить материалом для электродов аккумуляторов, что позволяет увеличить их энергоемкость и эффективность. Такие аккумуляторы могут использоваться в различных областях, от мобильных устройств до электрических автомобилей.
Таким образом, восстановленный металл, полученный при электролизе раствора кислоты, находит широкое применение в различных индустриальных и технологических процессах. Его высокая электропроводность, прочность и стабильность делают его ценным материалом в производстве электроники, металлических изделий и аккумуляторов.
Вопрос-ответ

Как происходит восстановление металла при электролизе раствора кислоты?
При электролизе раствора кислоты, металл восстанавливается на электроде из-за протекания электрического тока через раствор. Кислота в растворе разлагается на положительном электроде (аноде), при этом выделяется кислород, а металл восстанавливается на отрицательном электроде (катоде). Этот процесс называется восстановлением металла и является одним из способов получения металлов из их соединений.
Какие металлы можно восстановить при электролизе раствора кислоты?
При электролизе раствора кислоты можно восстановить множество различных металлов. Возможность восстановления зависит от реакционной способности металла и его электродного потенциала. Некоторые распространенные металлы, которые могут быть восстановлены, включают цинк, никель, железо, медь и свинец. Однако, каждый металл имеет свою степень реакционной способности и требует определенных условий для электролиза.
