Электролиз - это процесс, при котором электрический ток применяется для преобразования химических реакций. Одной из важных областей применения электролиза является восстановление металла на катоде. Катод – это электрод, на котором происходит восстановление металла из раствора.
Механизм восстановления металла на катоде включает несколько этапов. Сначала происходит окисление катиона металла, который находится в растворе, и образуется положительный ион металла, который перемещается к катоду. На поверхности катода происходит процесс восстановления, осуществляемый электродами. Здесь положительные ионы металла притягиваются к отрицательно заряженному катоду и получают избыточные электроны.
Важным фактором, влияющим на механизм восстановления металла на катоде, является активность металла и концентрация его ионов в растворе. Чем выше активность металла, тем легче он будет восстанавливаться на катоде. Также повышение концентрации ионов металла в растворе способствует более эффективному процессу восстановления.
Механизм восстановления металла

Механизм восстановления металла на катоде при электролизе раствора является сложным процессом, к которому приводят множество факторов. Одним из таких факторов является электрический ток, который проходит через раствор металлов и обеспечивает их восстановление. В результате этого процесса на катоде выпадает металл в виде металлического осаждения.
Основной механизм восстановления металла на катоде состоит из двух основных этапов. Вначале происходит трансфер электронов от катода к ионам металла в растворе. На этом этапе ионы металла получают электрон и превращаются в нейтральные атомы металла.
Далее, второй этап механизма восстановления металла на катоде описывает процесс адсорбции атомов металла на поверхности катода. Адсорбция происходит благодаря электростатическим и ван-дер-Ваальсовым силам притяжения между атомами металла и катодной поверхностью.
Важно отметить, что успешное восстановление металла на катоде зависит от нескольких факторов. Во-первых, это концентрация ионов металла в растворе. Чем выше концентрация, тем больше ионов будет доступно для восстановления на катоде. Во-вторых, влияние играет pH-значение раствора, температура и потенциал катода. Также важно учесть степень очистки поверхности катода от загрязнений и пузырей газов, которые могут препятствовать процессу восстановления металла.
В итоге, механизм восстановления металла на катоде при электролизе раствора предполагает передачу электронов, адсорбцию атомов металла на поверхности катода и окончательное образование металлического осаждения. Этот процесс является важным в области электрометаллургии и позволяет получать металлы высокой чистоты.
Электролиз раствора

Электролиз раствора – процесс, при котором протекает разложение электролита на положительно и отрицательно заряженные ионы под действием постоянного электрического тока. При электролизе раствора на электроды наносят постоянное напряжение, которое вызывает перенос ионов к электродам. Катод привлекает положительно заряженные ионы, анод – отрицательно заряженные ионы.
В процессе электролиза металлы могут осаждаться на поверхности катода, приводя к их восстановлению. Этот процесс называется электроосаждением и широко используется в промышленности для получения чистых металлов. Восстановление металла на катоде происходит благодаря передаче электронов от катода на металлоион, что приводит к его нейтрализации и осаждению на поверхности катода.
Важным параметром при электролизе раствора является плотность тока – отношение силы тока к площади катода. При увеличении плотности тока скорость осаждения металла на катоде также увеличивается. Однако, слишком высокая плотность тока может привести к неравномерному осаждению металла и образованию дефектов на покрытии.
Электролиз раствора широко применяется в различных отраслях промышленности, таких как производство металлов, гальваническое покрытие, электролитическое получение химических веществ, очистка сточных вод и другие. Контроль параметров процесса, таких как плотность тока, состав раствора и время процесса, позволяет получить качественный и стабильный результат.
Катод и его роль

Катод – это положительно заряженный электрод, который играет ключевую роль в процессе электролиза раствора. Он является местом, где анодные ионы или заряды, находящиеся в растворе, принимают электроны и происходит химическая реакция восстановления металла.
Роль катода заключается в том, что он служит местом притяжения ионов, которые перемещаются в растворе под воздействием электрического поля. К металлическому катоду притягиваются катионы, которые переносят положительный заряд. Когда катионы достигают поверхности катода, происходит реакция восстановления металла, и ионы встраиваются в кристаллическую решетку металла.
Катод обеспечивает протекание процесса электролиза и восстановление металла, обеспечивая сохранение его массы и структуры. Он играет важную роль в процессе электролиза раствора и является одним из ключевых элементов электролитической ячейки. Конструкция и материал катода, а также его размеры и форма, могут оказывать влияние на эффективность процесса и качество получаемого металла.
Процесс электролиза

Электролиз - это химический процесс, который осуществляется при помощи электрического тока. Когда ток проходит через раствор или плавленое вещество, происходят электрохимические реакции, в результате которых происходит разложение вещества на ионы.
Один из ключевых аспектов электролиза - это протекание электролитических реакций на электродах. За электроды принимаются анод (положительный электрод) и катод (отрицательный электрод). На аноде происходит окисление вещества и образование положительных ионов, а на катоде происходит восстановление ионов и образование нейтральных частиц.
Процесс восстановления металла на катоде является одной из основных электролитических реакций. При этом ионы металла принимают электроны от катода и осаждается металлическое вещество на поверхности катода. Это позволяет регенерировать использованный металл и эффективно использовать электролиз в промышленности для восстановления и очистки металлов.
Факторы, влияющие на восстановление

Восстановление металла на катоде при электролизе раствора может зависеть от нескольких факторов, которые оказывают влияние на этот процесс.
Первым и одним из основных факторов является концентрация редуцируемого вещества в растворе. Чем выше концентрация вещества, тем больше восстановление металла на катоде. Это связано с тем, что при высокой концентрации больше вещества попадает к катоду, что способствует его интенсивному восстановлению.
Также важным фактором является потенциал катода. Потенциал катода зависит от разности потенциалов катода и анода, а также от электродной плотности тока. Чем больше разница потенциалов, тем выше потенциал катода, что способствует его более интенсивному восстановлению.
Температура также оказывает влияние на восстановление. При повышении температуры происходит увеличение скорости реакции, что способствует более быстрому восстановлению металла на катоде.
Кроме того, важную роль играет также тип электролита. Различные электролиты имеют различное влияние на восстановление металла. Например, электролиты с наличием ионов металла имеют более высокую эффективность восстановления по сравнению с электролитами, не содержащими ионов металла.
Таким образом, концентрация редуцируемого вещества, потенциал катода, температура и тип электролита являются важными факторами, влияющими на восстановление металла на катоде при электролизе раствора.
Степень восстановления металла
Степень восстановления металла - это количественная оценка процесса, при котором ионы металла на катоде электролиза превращаются в нейтральные атомы или молекулы металла. Величина степени восстановления позволяет определить эффективность процесса и достоверность получаемого восстановленного металла.
Степень восстановления металла зависит от различных факторов, таких как концентрация металлического иона в растворе, температура, потенциал катода и т. д. Оптимальные условия для восстановления металла могут быть достигнуты с помощью контроля этих параметров.
Существует несколько методов для определения степени восстановления металла, включая анализ характеристик электрода, массовый баланс и анализ раствора после электролиза. Результаты этих методов могут быть представлены в виде числовых значений, процентных соотношений или графических иллюстраций.
Степень восстановления металла имеет практическое значение при производстве металлических изделий, таких как провода, покрытия и компоненты электроники. Высокая степень восстановления гарантирует качество исходного материала и обеспечивает требуемые свойства конечного изделия.
Зависимость от концентрации раствора
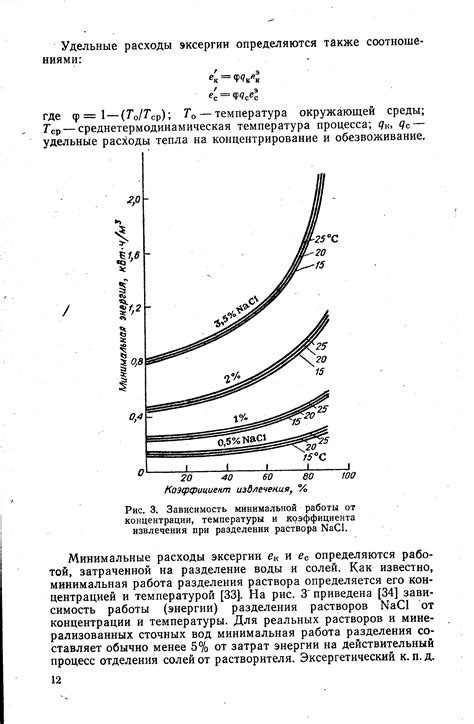
Механизм восстановления металла на катоде при электролизе раствора зависит от его концентрации. Концентрация раствора влияет на скорость восстановления металла и качество получаемого покрытия.
Высокая концентрация раствора обеспечивает более быстрое восстановление металла на катоде. Это связано с тем, что высокая концентрация раствора обеспечивает большую концентрацию ионов металла в растворе. Это позволяет большему количеству ионов металла подходить к поверхности катода и встраиваться в его кристаллическую решетку.
При низкой концентрации раствора процесс восстановления металла на катоде происходит медленнее. Это объясняется тем, что при низкой концентрации раствора меньше количество ионов металла доступно для восстановления на поверхности катода. Это приводит к медленному росту покрытия и более низкому качеству получаемого покрытия.
Зависимость от концентрации раствора является одним из важных параметров, которые нужно учитывать при определении оптимальных условий электролиза для получения качественного покрытия металла на катоде.
Вопрос-ответ

Как происходит восстановление металла на катоде при электролизе раствора?
В процессе электролиза раствора металл восстанавливается на поверхности катода. Приложенная к катоду электрическая сила тока приводит к передаче электронов с катода на ионы металла, находящиеся в растворе. Это позволяет атомам металла образовать слой на поверхности катода.
Какие факторы могут влиять на эффективность восстановления металла на катоде при электролизе раствора?
Эффективность восстановления металла на катоде зависит от нескольких факторов. Один из них - концентрация ионообразующих соединений в растворе. Чем выше концентрация, тем быстрее происходит процесс восстановления. Также важна температура раствора, которая может повлиять на процесс диффузии ионов к катоду. Наконец, влияние оказывает и приложенная электрическая потенциал к катоду.
