Процесс образования нерастворимой соли при реакции металла с кислотой является одной из основных реакций, происходящих в химии. Она основана на взаимодействии кислоты с металлом, в результате чего образуется новое вещество - соль.
Металл обычно реагирует с кислотой, выделяя газ и образуя соль. В зависимости от химической природы металла и кислоты, образующаяся соль может быть растворимой или нерастворимой в воде.
Нерастворимая соль образуется, когда химические свойства реагирующих веществ приводят к образованию малорастворимого соединения. Это происходит, например, когда металл образует стойкий осадок с кислотой, который не может быть растворен в воде.
Образование нерастворимой соли при реакции металла с кислотой является важным фундаментальным принципом в химии и имеет большое практическое значение. Эта реакция широко используется для получения различных соединений, обнаружении наличия определенных металлов и в других химических процессах.
Реакция металла с кислотой: образование нерастворимой соли

Одним из интересных явлений, связанных с химическими реакциями, является образование нерастворимой соли при взаимодействии металла с кислотой. Этот процесс можно наблюдать при проведении различных химических опытов.
При взаимодействии металла с кислотой происходит окислительно-восстановительная реакция, в результате которой образуется соль и выделяется водород. Однако, в некоторых случаях образованная соль является нерастворимой в воде.
Такая нерастворимость соли может быть обусловлена различными факторами. Например, формирующаяся соль может обладать низкой растворимостью в воде из-за своей структуры или электростатических взаимодействий. Кроме того, образуемая соль может быть нерастворимой на фоне большого избытка осадкообразующего компонента.
Образование нерастворимой соли имеет свои практические применения. Например, это используется при очистке воды от примесей и ионов металлов. В таких случаях нерастворимая соль выпадает на дно и может быть легко отделена от чистой воды.
Механизм образования соли
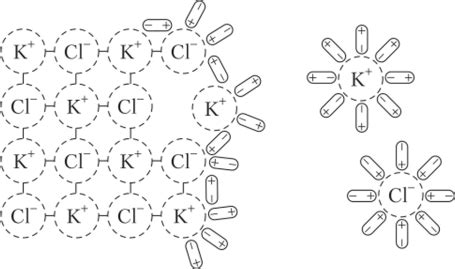
Образование нерастворимой соли при реакции металла с кислотой основывается на принципе обмена ионами между металлом и кислотой. Когда металл вступает в реакцию с кислотой, происходит окислительно-восстановительное взаимодействие, в результате которого происходит образование соли и выделение газа.
Механизм образования соли заключается в следующих этапах. Сначала металл отдаёт электроны, становясь положительным ионом. Тем временем, кислота отдаёт протоны, превращаясь в отрицательный ион. Затем положительный ион металла и отрицательный ион кислоты образуют кристаллическую решетку, состоящую из ионов соли.
Важно отметить, что образование нерастворимой соли зависит от растворимости данного соединения. Если растворимость соли невысока, то она осаждается в виде твёрдого осадка. Если же растворимость высока, то соль остаётся в растворе.
Механизм образования соли при реакции металла с кислотой является основой для понимания различных явлений в химии и имеет практическое применение в различных областях, включая производство, аналитику и исследования.
Влияние металла на свойства соли

Металл, который используется при реакции с кислотой, имеет значительное влияние на свойства образовавшейся соли. В зависимости от металла, соль может обладать различными физическими и химическими свойствами.
Первое, на что следует обратить внимание, это цвет соли. Разные металлы могут давать соли различных оттенков – от ярко-желтых и красных до белых и безцветных. Например, соль, образованная при реакции меди с кислотой, обычно имеет голубой или зеленый цвет, в то время как соль, образованная при реакции железа с кислотой, может быть красной или коричневой.
Вторым важным фактором является растворимость соли. Некоторые соли могут быть растворимыми в воде, а другие – нерастворимыми. Например, соли аминокислот, таких как аргинин или лизин, обычно растворимы в воде, в то время как соли некоторых тяжелых металлов, например свинца или меди, часто являются нерастворимыми.
Еще одним фактором, который может быть связан с металлом, является степень токсичности соли. Некоторые соли, содержащие определенные металлы, могут быть ядовитыми для организма. Это связано с особенностями взаимодействия металла с тканями организма и может потребовать особой осторожности при хранении и использовании таких солей.
Таким образом, металл играет ключевую роль в определении свойств образовавшейся соли при реакции с кислотой. Цвет, растворимость и степень токсичности соли могут изменяться в зависимости от металла, что важно учитывать при изучении химических реакций и их применении в различных областях науки и техники.
Применение нерастворимых солей

Нерастворимые соли – это вещества, которые не растворяются в воде или других растворителях при обычных условиях. Они обладают высокой устойчивостью к растворению и используются в различных областях.
Одним из применений нерастворимых солей является использование их в химическом анализе. Нерастворимые соли могут быть использованы для выделения и идентификации определенных элементов или ионов. Например, анализ воды может включать использование нерастворимых солей для отделения и определения содержания кальция или железа.
Другим применением нерастворимых солей является их использование в медицине. Некоторые нерастворимые соли могут применяться для производства лекарственных препаратов, таких как железо или кальций. Например, нерастворимый сульфат железа широко используется в качестве добавки к пище или витаминных комплексов.
Также нерастворимые соли могут использоваться в промышленности. Они могут быть использованы в процессах очистки воды, производстве стекла или керамики, а также в качестве катализаторов для химических реакций.
В заключение можно сказать, что нерастворимые соли имеют широкий спектр применения в различных областях, начиная от химического анализа и медицины и заканчивая промышленностью. Их уникальные свойства делают их полезными и востребованными в реализации различных задач и процессов.
Вопрос-ответ

Что происходит при реакции металла с кислотой? Как образуется нерастворимая соль?
При реакции металла с кислотой происходит образование солей и выделение водорода. Когда металл вступает в реакцию с кислотой, он отдает электроны, а ионы водорода выделяются в виде газа. В результате реакции образуется нерастворимая соль, которая может осаждаться в виде осадка.
Какие металлы образуют нерастворимые соли при реакции с кислотой?
Не все металлы образуют нерастворимые соли при реакции с кислотой. Это зависит от химических свойств металла и кислоты. Некоторые металлы, такие как свинец, серебро и ртуть, образуют нерастворимые соли с определенными кислотами. Например, реакция свинца с хлороводородной кислотой приводит к образованию нерастворимого хлорида свинца (PbCl2).
Какие факторы влияют на образование нерастворимой соли при реакции металла с кислотой?
Образование нерастворимой соли при реакции металла с кислотой зависит от нескольких факторов. Важнейшие из них - это химические свойства металла и кислоты, а также концентрация реагентов и условия реакции. Например, некоторые металлы образуют нерастворимые соли только с определенными кислотами, и их образование может быть стимулировано повышением концентрации реагентов или увеличением температуры реакции.
Какие свойства имеют нерастворимые соли, образующиеся при реакции металла с кислотой?
Нерастворимые соли, образующиеся при реакции металла с кислотой, обладают рядом характерных свойств. Они обычно имеют низкую растворимость в воде и могут осаждаться в виде осадка или кристаллов. Эти соли обычно имеют определенную структуру и свойства, которые отличают их от растворимых солей. Например, нерастворимые соли часто обладают низкой электропроводностью и могут образовывать стойкие осадки.
