Вступление

Металлы проявляют различную активность при контакте с водными растворами солей. Реакция металла с водным раствором сульфата меди 2 является одной из таких химических реакций. В ходе этой реакции происходит обмен ионами, и металл замещает медь в ее соединении, что приводит к образованию продуктов реакции и выделению энергии. Давайте рассмотрим эту реакцию подробнее.
Ход реакции

- В начале реакции металл, например, цинк (Zn), контактирует с водным раствором сульфата меди 2 (CuSO4).
- Металл цинк обладает большей активностью, чем медь, поэтому он вытесняет медь из ее соединения.
- В результате этой замещающей реакции образуется новое вещество - сульфат цинка (ZnSO4).
- Сульфат меди 2 (CuSO4) теряет медь и становится свободным ионом меди (Cu2+).
- Образовавшаяся медь выпадает в осадок, что делает водный раствор мутным.
Уравнение реакции

Уравнение реакции металла с водным раствором сульфата меди 2 записывается следующим образом:
Zn + CuSO4 → ZnSO4 + Cu
Факторы, влияющие на скорость реакции

Скорость реакции металла с водным раствором сульфата меди 2 зависит от нескольких факторов:
- Температура водного раствора: при повышении температуры скорость реакции обычно увеличивается.
- Концентрация сульфата меди 2: чем выше концентрация, тем быстрее протекает реакция.
- Размер и форма металлического образца: более мелкое распределение частиц повышает протекание реакции.
Вывод

Реакция металла с водным раствором сульфата меди 2 является обменной реакцией, при которой металл замещает медь в ее соединении. Образуются новые продукты реакции - сульфат металла и осадок меди. Реакция может протекать с различной скоростью в зависимости от температуры, концентрации и размера металлического образца.
Характеристика водного раствора сульфата меди 2
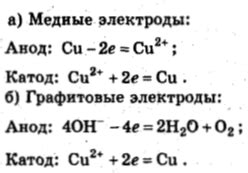
Сульфат меди 2, или куприй-сульфат, представляет собой соль, образующую нерастворимые синие кристаллы. В водном растворе сульфат меди 2 проявляет ряд характеристических свойств, которые определяют его особенности и области применения.
Во-первых, сульфат меди 2 обладает высокими антисептическими свойствами. Это означает, что раствор сульфата меди 2 может убивать или задерживать развитие бактерий, вирусов и грибков. Именно благодаря этому свойству сульфат меди 2 широко применяется в медицине и ветеринарии для лечения и предотвращения инфекционных заболеваний.
Во-вторых, раствор сульфата меди 2 обладает отличными окрашивающими свойствами. Благодаря взаимодействию со свободными ионоами меди, раствор приобретает яркий синий цвет. Это свойство находит применение в химической промышленности, исследованиях и разработках, а также при проведении химического анализа.
Кроме того, сульфат меди 2 позволяет образовывать прочные соединения с различными веществами. Это свойство используется в гальванических процессах для создания покрытий на металлических поверхностях, а также в производстве гербицидов и инсектицидов.
В заключение, водный раствор сульфата меди 2 обладает антисептическими, окрашивающими и прочными свойствами, которые находят широкое применение в медицине, промышленности и научных исследованиях.
Вопрос-ответ

Какая реакция происходит между металлом и водным раствором сульфата меди 2?
При взаимодействии металла с водным раствором сульфата меди 2 происходит замещение меди металлом. Например, если использовать цинковую монетку, то цинк будет реагировать с ионами меди, вытесняя медь из раствора. В результате образуется осадок меди на поверхности металла.
Каким образом происходит реакция металла с водным раствором сульфата меди 2?
Реакция между металлом и водным раствором сульфата меди 2 основана на принципе замещения. Металл, обладающий большей активностью, вытесняет из раствора металл, обладающий меньшей активностью. В данном случае, ионы меди, находящиеся в растворе сульфата меди 2, сталкиваются с поверхностью металла и образуют осадок меди.
Какие металлы реагируют с водным раствором сульфата меди 2?
Многие металлы обладают способностью реагировать с водным раствором сульфата меди 2. Например, цинк, железо, алюминий, никель, свинец и др. Для проведения подобных реакций необходимо иметь металлическую поверхность, на которую ионы меди смогут осаждаться в виде медного налета.
Какие реакции между металлами и водными растворами сульфата меди 2 могут использоваться в химических экспериментах?
В химических экспериментах можно использовать различные металлы, которые реагируют с водными растворами сульфата меди 2. Например, можно определить активность металлов, сравнивая их способность вытеснять медь из раствора. Также можно изучать скорость реакции или определять массу образовавшегося металлического осадка.
