Реакция металлов с растворами солей является фундаментальным процессом в химии. Этот процесс важен для понимания многих аспектов химических реакций и применяется в различных областях науки и промышленности, включая металлургию, электрохимию и аналитическую химию.
Взаимодействие металлов с растворами солей может происходить разными способами. Некоторые металлы, такие как натрий и калий, обладают высокой реактивностью и могут реагировать с водными растворами солей сразу после контакта. В результате такой реакции может образовываться газ или осадок, в зависимости от веществ, участвующих в реакции.
Другие металлы, такие как алюминий или железо, могут реагировать с растворами солей только при нагревании или при наличии катализатора. В таких случаях реакция между металлом и солью может приводить к образованию новых соединений или растворению металла в растворе.
Реакции металлов с растворами солей имеют большое практическое значение. Например, такие реакции используются для получения металлов из руды или старых изделий, для очистки воды и в процессе гальванического покрытия. Кроме того, изучение этих реакций позволяет лучше понимать принципы работы различных химических процессов и разрабатывать новые методы и технологии.
Влияние растворов солей на реакцию металлов
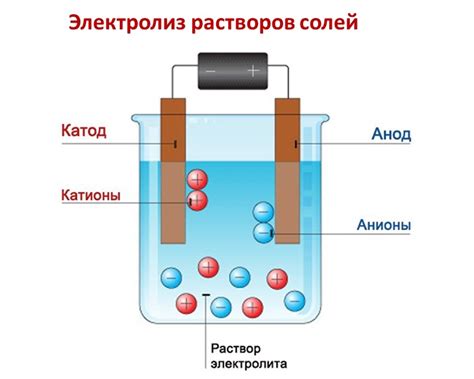
Металлы — это элементы, которые обладают высокой электропроводностью и хорошей теплопроводностью. Они широко применяются в различных отраслях промышленности и являются неотъемлемой частью нашей жизни.
Реакция металлов с растворами солей представляет собой химическое взаимодействие, которое может протекать с разной интенсивностью, в зависимости от многих факторов. Самый важный из них — активность металла, которая определяется его положением в электрохимическом ряду.
Металлы могут проявлять различные химические свойства при взаимодействии с растворами солей. Некоторые металлы, такие как железо, цинк, алюминий, обладают достаточно высокой активностью и способны вытеснить менее активные металлы из их солей. Это явление называется электрохимическим рядом активности металлов.
Однако не все металлы имеют такую способность. Например, серебро и золото практически не реагируют с растворами солей других металлов. Это связано с их низкой активностью и стабильностью их соединений.
Реакция металлов с растворами солей может происходить с образованием осадка, газа или эволюцией тепла. Например, при взаимодействии цинка с раствором соли меди, образуется осадок цинка и ион меди, что можно наблюдать в виде цветного покрытия на поверхности цинковой детали.
Восстановление металлов в растворах солей

Металлы – элементы, характеризующиеся прекрасными свойствами проводить электрический ток и тепло. Из этой группы элементов большинство имеют способность вступать в реакции с растворами солей, причем реакция заключается в их восстановлении.
Восстановление – это химическая реакция, в результате которой происходит переход элемента из положительной степени окисления в отрицательную. В процессе восстановления металла восстанавливающее вещество получает электроны от окисляемого вещества – иона металла. Таким образом, металл выводится из состояния ионного комплекса и превращается в неполярное соединение.
Восстановление металлов в растворах солей может происходить различными способами, включая электролиз, обменные реакции, использование восстановителей и другие. Одним из наиболее распространенных методов является электролиз – процесс растворения металла под действием электрического тока.
- Восстановление металлов в растворах солей имеет широкое применение в различных областях. Например, в металлургии процесс восстановления используется для получения металлов из их солей, а также для очистки металлических поверхностей от окиси.
- Также восстановление металлов является важным этапом в процессе производства электролитических конденсаторов, где металл выводится из состояния иона и осаждается на электроде.
Итак, восстановление металлов в растворах солей представляет собой важнейший процесс, который находит применение во многих отраслях промышленности и науки.
Образование осадка при взаимодействии металлов с солями

Реакция металлов с растворами солей является одной из основных химических реакций, которая приводит к образованию осадка. Осадок представляет собой нерастворимое вещество, которое выпадает в виде мелких частиц и может образовывать отложения на поверхностях или закупоривать систему, в которой происходит реакция.
При взаимодействии металлов со солями может происходить обмен ионами, что приводит к образованию новых соединений. Реакция может происходить как в растворе, так и на поверхности металла. В результате обмена ионов металл может соединиться с анионом из раствора, образуя осадок.
Образование осадка при взаимодействии металлов с солями зависит от различных факторов, включая концентрацию раствора, pH среды, температуру и свойства металла и соли. Некоторые металлы, такие как свинец, серебро и ртуть, способны быстро образовывать осадки с различными солями, в то время как другие металлы могут быть менее реактивными.
Образование осадка может иметь практическое значение, например, в области водоочистки, где осадки могут быть удалены из воды для очистки ее от загрязнений. Также образование осадка может быть использовано для аналитических целей, например, для определения наличия определенных металлов в образце.
Итак, взаимодействие металлов с солями может привести к образованию осадка, что имеет значение как с практической, так и с аналитической точек зрения. Понимание этого процесса позволяет более эффективно управлять образованием и удалением осадков, а также использовать его в аналитических методах.
Взаимодействие различных металлов с разными солями

Металлы могут проявлять различные химические реакции при взаимодействии с растворами солей. Эти реакции зависят от свойств как металла, так и соли.
Реакция алюминия с солями железа
Алюминий обладает высокой активностью и может реагировать с различными солями железа. Например, при взаимодействии алюминия с раствором соли железа (III) происходит выделение гидроксида алюминия и осаждение гидроксида железа (III). Эта реакция широко используется в лаборатории для определения алюминия и железа в пробах.
Реакция железа с солями меди
Железо может вступать в реакцию с растворами солей меди и образовывать осадок. Например, при взаимодействии железа с раствором сульфата меди (II) образуется осадок медного гидроксида. Эта реакция может использоваться для определения железа в пробах и исследования его концентрации в различных растворах.
Реакция цинка с солями свинца
Цинк обычно реагирует с растворами солей свинца и образует осадок цинкового гидроксида. Например, при взаимодействии цинка с раствором нитрата свинца (II) происходит образование осадка цинкового гидроксида и образуется токсичный нитрат цинка. Эта реакция может использоваться для определения наличия цинка в пробах.
Реакция меди с солями железа
Медь может реагировать с растворами солей железа и образовывать осадок. Например, при взаимодействии меди с раствором сульфата железа (II) образуется осадок железного гидроксида. Эта реакция может использоваться для определения наличия меди в пробах и исследования ее концентрации в растворах.
Роль растворов солей в электрохимических реакциях металлов

Растворы солей играют важную роль в электрохимических реакциях металлов. Реакция раствора соли с металлом происходит благодаря обмену электронами между ионами металла и ионами соли. В результате этих реакций могут образовываться осадки, растворы или электроды, которые влияют на окислительно-восстановительные свойства металлов.
Металлы могут реагировать с растворами солей через процессы окисления и восстановления. Во время окисления металл отдает электроны, становясь положительным ионом. Восстановление, наоборот, происходит, когда металл принимает электроны от отрицательных ионов в растворе соли, превращаясь в нейтральный атом или атом различной степени окисления.
Растворы солей также имеют влияние на электрический потенциал металлов. Когда металл находится в растворе своей соли, его электрический потенциал может изменяться, что влияет на его реакционную способность и химические свойства.
Растворы солей могут использоваться для проведения электролиза, то есть разложения соединений на ионы при помощи электрического тока. Электролитический разложение металлов и их соединений позволяет получать вещества с высокой степенью очистки и использовать их в различных технологических процессах.
Важно отметить, что электрохимические реакции металлов в растворах солей зависят от концентрации соли, pH раствора, температуры и других факторов. Поэтому при изучении этих реакций необходимо учитывать данные параметры и проводить эксперименты с соблюдением определенных условий.
Влияние концентрации растворов солей на реакцию с металлами
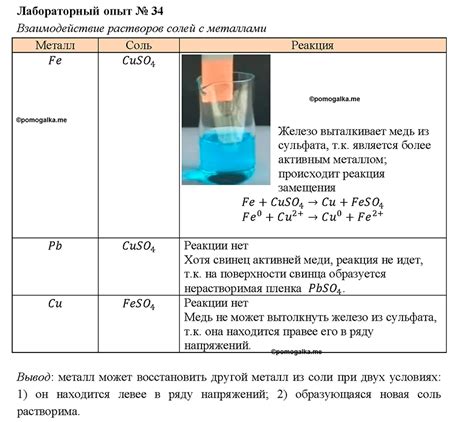
Реакция металлов с растворами солей является химической реакцией, в результате которой происходит образование новых веществ. Концентрация раствора соли играет важную роль в этой реакции, поскольку она влияет на скорость и интенсивность протекающих процессов.
При повышении концентрации раствора соли происходит увеличение количества ионов этой соли, а следовательно, возрастает вероятность их столкновений с металлической поверхностью. Это способствует активации химической реакции и ускорению скорости образования новых веществ.
Однако при слишком высокой концентрации раствора соли может происходить образование осадка, который может оказывать защитное действие на металлическую поверхность и затормаживать протекание реакции.
Таким образом, концентрация раствора соли является важным фактором, который определяет интенсивность реакции металла с солью. Оптимальная концентрация раствора соли позволяет достичь максимальной скорости реакции и эффективно использовать металл в химической системе.
Вопрос-ответ

Как металлы проявляют химическую реакцию с растворами соли?
Металлы реагируют с растворами соли, образуя соли металлов и выделяя газы. Реакция может проявляться в виде пузырьков газа, выделения тепла или изменения цвета раствора.
Какие металлы реагируют с растворами соли?
Реакция металлов с растворами солей зависит от их активности. Например, металлы такие как натрий, калий и магний реагируют более активно, чем металлы такие как железо или медь.
Какие продукты образуются при реакции металлов с растворами солей?
Реакция металлов с растворами солей приводит к образованию солей металлов и выделению газов. Например, реакция натрия с раствором хлорида натрия приводит к образованию хлорида натрия и выделению газа хлора.
