Реакция раствора щелочи с металлами является одним из основных химических процессов, которые происходят в нашей повседневной жизни. Щелочные растворы, такие как гидроксид натрия или гидроксид калия, обладают сильными щелочными свойствами и могут взаимодействовать с различными металлами. Эта реакция имеет важное практическое применение в различных отраслях промышленности и науке.
Уравнение реакции раствора щелочи с металлом можно представить следующим образом: гидроксид металла + металл → металлический гидроксид. Например, реакция натриевого гидроксида с алюминием будет выглядеть следующим образом: 2NaOH + 2Al → 2NaAlO2 + H2. В результате реакции образуется соединение, называемое металлическим гидроксидом, и выделяется водород.
Механизм реакции раствора щелочи с металлами является сложным и может зависеть от типа металла и конкретного щелочного раствора. Однако основной механизм реакции заключается в том, что ионы гидроксида щелочи вступают во взаимодействие с поверхностью металла, что приводит к образованию гидроксидных комплексов. Далее, металлические ионы растворяются в реакционной среде и образуют соответствующие гидроксиды.
Реакция раствора щелочи с металлами имеет множество практических применений. Например, она может использоваться для очистки поверхности металла от окислов и загрязнений, для производства водорода или различных соединений металлов, а также в лабораторных исследованиях и процессах синтеза.
Реакция раствора щелочи с металлами
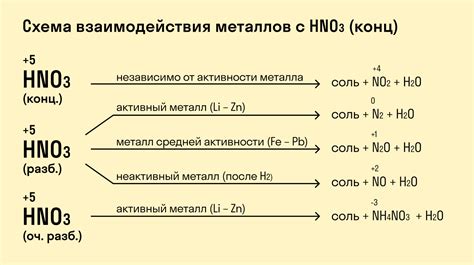
Реакция раствора щелочи с металлами - это химический процесс, при котором происходит взаимодействие между раствором щелочи и металлами. Щелочь является основой и в данном случае играет роль реагента.
Как правило, реакция раствора щелочи с металлами начинается с образования гидроксидов металлов и выделения водорода. Данный процесс обусловлен химическими свойствами щелочей, которые проявляются в способности ионизироваться в растворе и образовывать гидроксиды.
Также стоит отметить, что реакция щелочи с металлами обычно протекает с выделением тепла и является экзотермической. Это обусловлено экзотермическими свойствами самой реакции, которая сопровождается образованием новых химических связей и освобождением энергии.
Реакция раствора щелочи с металлами имеет широкое применение в различных областях. Например, такие реакции используются в металлургии для получения и очистки металлов, в химической промышленности для производства различных соединений и материалов, а также в аналитической химии для определения содержания металлов в различных образцах.
Уравнение гидроксида металла и щелочного удаления гидрогена

Гидроксид металла — это основа, которая образуется при растворении металла в воде. Раствор гидроксида металла является щелочным, так как он содержит гидроксидные ионы (OH-) - основу. Гидроксидный ион является носителем отрицательного заряда и способен принимать протоны, т.е. находиться в состоянии диссоциации.
Реакция гидроксида металла с кислотой осуществляется с образованием соли и воды. В данном случае гидроксид металла реагирует с кислородным протоном кислоты, образуя соль и молекулу воды. Эта реакция происходит в соответствии с основной химической реакцией Ne(H2O)n + OH- → Ne(H2O)n+1, где Ne - металл, H2O - вода, OH- - гидроксидный ион.
При этом в гидроксиде металла происходит удаление гидрогена, который образует комплекс соответствуюющего металла и воды. Гидроген может быть удален путем протолитической диссоциации, то есть образованием комплекса металла и образованием иона гидроксида.
Таким образом, уравнение реакции гидроксида металла с щелочью можно записать следующим образом: M(OH)n + OH- → MOHn+1 + H2O, где M - металл, OH- - гидроксидный ион, n - количество гидроксидных групп в соответствующем щелочном растворе.
Механизм взаимодействия металлов с гидроксидом

Металлы могут реагировать с гидроксидами, образуя гидроксид металла и выделяя водород. Данная реакция осуществляется по следующему механизму:
- Диссоциация гидроксида. Гидроксид диссоциирует на ионы гидроксила (OH-) в растворе.
- Пассивация металла. Металл поверхности пассивируется слоем гидроксида металла, что создает защитную оксидную пленку.
- Катодный процесс. Вода окисляется на катоде, образуя водород и электроны.
- Анодный процесс. Металл окисляется на аноде, переходя в ионную форму.
- Выделение водорода. Образовавшийся водород выводится из раствора в виде пузырьков.
Таким образом, реакция металлов с гидроксидами является электрохимической, где металл выступает в качестве катода, а вода окисляется на аноде. Образующийся гидроксид металла является осадком в растворе и может быть использован в различных химических и промышленных процессах.
Вопрос-ответ

Какие металлы реагируют с щелочами?
Реакция раствора щелочи с металлами происходит только с активными металлами, такими как натрий, калий, литий и алюминий.
Каково уравнение реакции раствора щелочи с металлом?
Уравнение реакции зависит от конкретного металла и щелочи, но обычно выглядит следующим образом: 2М + 2NaOH -> 2MОН + Н2, где М обозначает металл.
