Коррозия металла – это процесс разрушения и повреждения материала под воздействием окружающей среды. В основе коррозии лежат два взаимосвязанных механизма: окисление и восстановление. Окисление – это процесс потери электронов в результате реакции с кислородом или другими окислительными средствами. Восстановление – это обратная реакция, при которой ионы металла возвращаются к своему первоначальному состоянию.
Окисление металла происходит в результате взаимодействия с кислородом из воздуха или воды. Металлический материал служит анодом в электрохимической реакции окисления, тогда как вода или влага воздействуют в качестве электролита. В процессе окисления металл утрачивает электроны, которые передаются кислороду, образуя ионы оксида металла. Этот процесс сопровождается образованием коррозионных продуктов – окислов и гидроксидов металла, которые образуют защитную пленку на поверхности металла.
Однако, восстановительные реакции также играют важную роль в процессе коррозии металла. Восстановление – это процесс возвращения ионов металла к исходному состоянию. Оно происходит в присутствии веществ, способных передать электроны металлическому материалу. Такие реакции происходят в сторону уменьшения окислительности металла и препятствуют разрушению металла под воздействием окружающей среды.
Механизмы коррозии металла

Коррозия металла – это процесс разрушения материала, вызванный химическими или электрохимическими реакциями, протекающими между металлом и окружающей средой. Основными механизмами коррозии металла являются окисление и восстановление.
Окисление – это процесс, в котором металл вступает в реакцию с кислородом, приводящую к образованию металлического оксида. Данная реакция происходит при наличии воды или влаги, что обычно встречается в окружающей среде. Оксид образует тонкую пленку на поверхности металла, которая может действовать как защита или, наоборот, способствовать дальнейшей коррозии.
Восстановление – это обратная реакция, в ходе которой металлический оксид возвращается к своему металлическому состоянию. Этот процесс может возникать при наличии электролитической среды или в результате воздействия других электрохимически активных веществ.
Важно отметить, что окисление и восстановление неразрывно связаны и составляют один из основных механизмов коррозии металла. При коррозии металла происходит потеря его структурной прочности, что может привести к разрушению конструкций и деталей, что делает важной задачу разработки методов предотвращения и защиты от коррозии.
Роль окисления в коррозии металла

Окисление является одним из главных механизмов, отвечающим за коррозию металла. Оно представляет собой химическую реакцию, при которой происходит потеря электронов металлом и образование окиси или иона металла.
Влияние окисления на процесс коррозии заключается в том, что оно способствует разрушению внутренней структуры металла. При окислении на поверхности металла образуется окисная пленка, которая может быть пористой и несовершенной. Это способствует проникновению влаги и агрессивных веществ внутрь металла, что приводит к его дальнейшему разрушению.
Окисление металла происходит под влиянием кислорода, содержащегося в окружающей среде. Кислород активно реагирует с металлом, образуя оксиды или гидроксиды металла. Например, на поверхности железа образуется ржавчина – гидроксид железа(III).
Влияние окисления на коррозию металла также связано с электрохимическими процессами. Окисление является анодной реакцией, что означает, что оно происходит на аноде внутри гальванической пары. При этом, вторая половина пары – восстановление – происходит на катоде, что ещё больше усиливает коррозию металла.
Для предотвращения коррозии металла необходимо применять методы защиты, которые могут замедлить или полностью остановить процесс окисления. Важно также учитывать окружающую среду, в которой находится металл, и принимать меры по контролю её воздействия на металлическую поверхность.
Процесс восстановления металла

Восстановление металла – это процесс, в результате которого окисленные металлические ионы превращаются обратно в исходное металлическое состояние. Этот процесс является противоположным процессу окисления, который приводит к образованию коррозии и разрушению металла.
Восстановление металла может происходить при взаимодействии металла с веществами, способными передавать электроны. При этом происходит перенос электронов с вещества, обладающего более высоким потенциалом окисления, на металл, который имеет более низкий потенциал окисления. Таким образом, металл возвращается в свою исходную металлическую форму и снижается степень его окисления.
Процесс восстановления металла может происходить как в присутствии кислорода, так и в его отсутствии. Возможны различные механизмы восстановления, включая химическую реакцию среды с металлом, электрохимическую реакцию, а также взаимодействие с восстановителями, включающими различные вещества и соединения.
Процесс восстановления металла является важным при восстановлении и восстановительных процессах в промышленности. Восстановленный металл может быть использован повторно или применен в других процессах производства. Кроме того, восстановление металла также позволяет предотвратить разрушение и повреждение металлических изделий, вызванные процессом коррозии.
Воздействие окружающей среды на коррозию

Окружающая среда имеет существенное влияние на процесс коррозии металла. Различные факторы окружающей среды могут стимулировать или замедлить процесс окисления и восстановления, что в свою очередь влияет на скорость коррозии.
Одним из основных факторов, влияющих на коррозию, является содержание влаги. Влажная среда обеспечивает необходимые условия для активации электрохимических процессов, что ускоряет окисление и восстановление металла. При этом, конденсация влаги на поверхности металла может приводить к образованию капель, которые создают места концентрации окислительных и восстановительных реакций.
Также, кислотное или щелочное окружение может значительно повысить скорость коррозии. Кислотная среда образуется при взаимодействии металла с кислотными растворами, а щелочная - при взаимодействии металла с щелочными растворами. В обоих случаях происходит образование ионов, которые участвуют в электрохимических процессах.
Еще одним важным фактором, влияющим на коррозию, является наличие кислорода или других окислителей в окружающей среде. Кислородная коррозия является наиболее распространенным типом коррозии и происходит при окислении металла воздушным кислородом. Воздействие оксидирующих веществ, таких как хлор или сероводород, также может приводить к быстрой коррозии металла.
Воздействие окружающей среды на коррозию также зависит от типа металла. Некоторые металлы более устойчивы к коррозии, в то время как другие металлы более активно реагируют с окружающей средой. Например, алюминий реагирует с влагой и кислородом, образуя оксидные пленки, которые могут защищать металл от дальнейшей коррозии. Однако, железо реагирует с кислородом и влагой, образуя ржавчину, которая ускоряет процесс коррозии.
Катодный и анодный процессы в коррозии
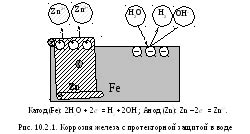
Коррозия металла – это процесс разрушения металлических материалов в результате их взаимодействия с окружающей средой. Коррозия происходит вследствие электрохимических реакций, которые происходят на поверхности металла. Важную роль в коррозии играют катодные и анодные процессы.
Катодный процесс – это процесс уменьшения заряда металла, когда металл находится в контакте с окислительным средством. Катодный процесс заключается в принятии электронов металлом из окислительного средства. При этом на поверхности металла образуется слой оксида, который может быть либо растворимым, либо нерастворимым.
Анодный процесс – это процесс увеличения заряда металла, когда металл находится в контакте с восстановительным средством. Анодный процесс заключается в отдаче электронов металлом в восстановительное средство. В результате этого процесса на поверхности металла возникают негативно заряженные ионы, которые в дальнейшем могут растворяться в окружающей среде.
Катодные и анодные процессы в коррозии происходят одновременно и взаимосвязаны между собой. Их скорость определяется разницей в электропотенциале металла и окружающей среды. Если разница в электропотенциале небольшая, то процесс коррозии металла будет медленным. В случае же большой разницы в электропотенциале, процесс коррозии будет быстрее и более интенсивным.
Химические реакции при окислении металла

При окислении металла происходят различные химические реакции, которые вызывают коррозию и разрушение материала. Окисление представляет собой процесс, при котором металл реагирует с кислородом воздуха или с другими химическими веществами, что приводит к образованию оксидов металла. Эти оксиды являются основными компонентами коррозионных продуктов, которые образуются на поверхности металла в результате окисления.
Одной из наиболее распространенных реакций при окислении металла является реакция с кислородом воздуха. Например, железо, подверженное окислению, реагирует с кислородом и образует ржавчину, которая состоит из оксида железа (III). Это образование ржавчины может привести к разрушению металлического изделия и значительным потерям в его стойкости и прочности.
Окисление металла также может происходить в результате реакции с водой. Например, алюминий, контактируя с водой, прореагирует с молекулами воды, образуя оксид алюминия и высвобождая водород. Такие коррозионные реакции могут возникнуть при контакте металла с водной средой или при длительном пребывании металлического изделия во влажной среде.
- Важно отметить, что скорость окисления металла зависит от его химической активности и условий окружающей среды.
- Также стоит добавить, что при окислении металла могут образовываться различные химические соединения, включая соли и гидроксиды.
- Некоторые металлы, такие как золото или платина, обладают высокой стойкостью к окислению и мало подвержены коррозии.
В целом, процесс окисления металла является важным аспектом в химии и материаловедении, так как позволяет учитывать химическую активность и стойкость металлических материалов в разных средах и условиях эксплуатации.
Профилактика и защита от коррозии

Коррозия металла является проблемой, которую необходимо регулярно контролировать и предотвращать. Для этого существует несколько методов профилактики и защиты от коррозии, которые позволяют сохранить металлические изделия в хорошем состоянии на длительный период времени.
Одним из основных способов предотвратить коррозию металла является применение специальных защитных покрытий. Они создают на поверхности металла непроницаемую пленку, которая не позволяет воздействию окружающей среды проникать внутрь и вызывать процессы окисления. Такие покрытия могут быть нанесены как методом окрашивания, так и путем гальванического осаждения.
Другим важным методом профилактики коррозии является регулярное обслуживание и техническое обслуживание металлических изделий. При этом необходимо удалять накопившийся на поверхности металла грязь и пыль, а также проводить проверку наличия повреждений или потери защитных покрытий. При обнаружении повреждений необходимо незамедлительно их исправлять, чтобы избежать продолжения процессов коррозии.
Также стоит уделять внимание окружающей среде, в которой находится металлическое изделие. Влажность, наличие агрессивных химических веществ или повышенная температура могут ускорить процессы коррозии. Поэтому важно предусматривать соответствующие условия эксплуатации и хранения металлических изделий.
Однако, несмотря на все меры предосторожности, полностью избежать коррозии металла невозможно. Поэтому важно регулярно проводить контроль и диагностику состояния металла, чтобы в случае необходимости принять меры по его восстановлению и защите. Это позволит сохранить металлические изделия в рабочем состоянии и продлить их срок службы.
Вопрос-ответ

Как происходит коррозия металла?
Коррозия металла происходит по механизму окисления, когда металл контактирует с воздухом или водой. Металл постепенно окисляется, что приводит к разрушению его структуры.
Какие факторы влияют на скорость коррозии металла?
Скорость коррозии металла зависит от нескольких факторов, включая тип металла, температуру, влажность, pH-уровень и наличие агрессивных веществ в окружающей среде.
Как можно предотвратить коррозию металла?
Коррозию металла можно предотвратить, применяя различные методы защиты, такие как гальваническая защита, использование покрытий, антикоррозионные препараты и правильное хранение металлических изделий.
Какие методы используются для удаления коррозии с металла?
Для удаления коррозии с металла можно использовать различные методы, включая механическое очищение (например, шлифовка), химическую обработку (с использованием специальных растворов) и электрохимические методы (например, электролиз).
Какие вещества могут служить антикоррозионными препаратами?
Антикоррозионными препаратами могут служить различные вещества, такие как органические растворители, фосфаты, сурьма, цинк и хроматы. Они создают защитную пленку на поверхности металла, предотвращая его окисление.
