В химии существует много способов получения различных металлов. Один из таких методов – электролиз водного раствора их солей. Этот процесс основан на использовании электричества для разложения водных растворов металлических солей на ионы. Затем ионы металла, благодаря электролитическим реакциям, превращаются в чистый металл.
Один из примеров такого металла – медь. Медь является одним из самых важных промышленных металлов, который широко используется в различных отраслях, включая электротехнику, строительство и производство монет. Электролиз водного раствора сульфата меди позволяет получить чистую медь. В процессе электролиза медионо остается на аноде, а медь осаживается на катоде.
Еще одним примером такого металла является никель. Никель – серебристо-белый металл, который широко используется в производстве легированных сталей, а также в производстве никелевых аккумуляторов и монет. Никель можно получить через электролиз водного раствора никельсульфата. В процессе электролиза никелевые ионы осаждается на катоде, а сернокислые ионы перемещаются к аноду.
Что такое электролиз?
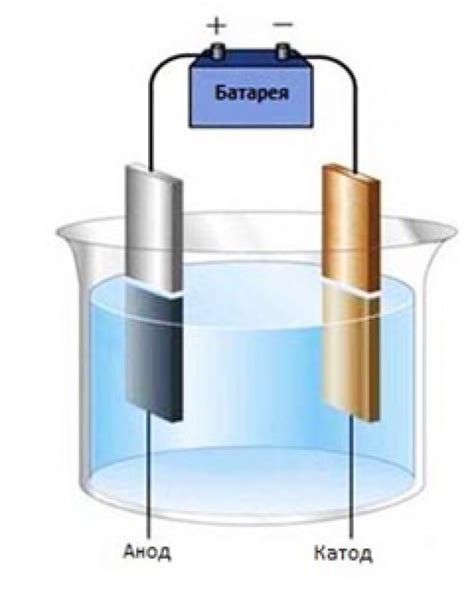
Электролиз - это процесс, который осуществляется при воздействии электрического тока на водный раствор или расплав солей. В результате проведения электролиза происходит разложение раствора на ионы и их перераспределение под действием электрического поля.
При процессе электролиза положительно заряженные ионы притягиваются к отрицательному электроду, называемому катодом, в то время как отрицательно заряженные ионы мигрируют к положительному электроду, называемому анодом. На катоде происходит процесс восстановления ионов с образованием вещества, а на аноде - окисление ионов с образованием других веществ или выделением газа.
В процессе электролиза важную роль играют электролит и электроды. Электролит - это вещество, способное проводить электрический ток. Он может быть представлен как раствор солей или кислот, так и расплавленным состоянием металлов. Электроды - это проводники, к которым подключен внешний источник электрического тока. Один из электродов соединен с положительным выводом источника, а другой - с отрицательным.
Какое металл можно получить электролизом?

Электролиз - это процесс разложения вещества на ионы под воздействием электрического тока. Один из результатов электролиза водного раствора соли - получение металла.
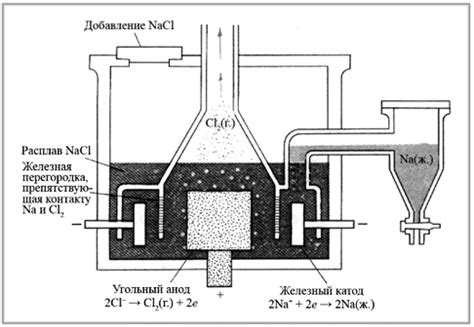
Многие металлы могут быть получены электролизом, однако конкретный металл зависит от раствора его соли. Например, для получения металла натрия необходимо использовать раствор хлорида натрия (NaCl).
При электролизе такого раствора на катоде образуются ионы натрия (Na+), которые приводят к выделению металлического натрия. Таким образом, электролиз позволяет получить металл натрия из его соли.
Аналогично можно получить другие металлы, например, калий (K), магний (Mg), алюминий (Al) и т.д., используя соответствующие соли и проводя электролиз.
Электролиз также применяется для получения ряда других металлов, таких как медь (Cu), никель (Ni), цинк (Zn) и др. Однако для этих металлов чаще используют не водные растворы их солей, а плавление их соединений.
Процесс получения металла электролизом
Электролиз является одним из основных методов получения различных металлов. Он основан на применении электрического тока для разложения соединений металла в водном растворе его соли. Процесс получения металла электролизом происходит с использованием электролитической ячейки.
В электролитической ячейке металлический катод и анод погружены в раствор соли металла. При подаче электрического тока к аноду происходит окисление молекул металла, что приводит к их разложению на ионы металла. Ионы металла перемещаются к катоду, где при погружении на поверхность катода они получают электроны и образуют металлический осадок.
Важным параметром при электролизе является выбор электролита. Он должен быть выбран так, чтобы содержащиеся в нем ионы металла были способны вступать в процесс электролиза. Также важно контролировать ток электролиза и длительность процесса для получения нужного количества металла.
Процесс электролиза позволяет получать металлы с высокой степенью чистоты и точностью контролировать полученное количество. Электролиз широко применяется в металлургии, где его преимуществом является возможность получения качественного и высокопрочного материала.
Какие соли можно использовать для электролиза?

Электролиз - это процесс, при котором электрический ток приводит к разложению вещества на ионы. Для осуществления электролиза водного раствора соли, необходимо выбрать подходящую соль. Различные соли могут быть использованы в электролизе для получения различных металлов.
Магниевая соль - один из примеров солей, которые могут использоваться для электролиза. При электролизе магниевой соли водного раствора, на катоде образуется металлический магний, которым можно получить гранулированный магний или его сплавы.
Цинковая соль - еще один пример соли, который может быть использован для электролиза. При электролизе цинковой соли водного раствора, на катоде накапливается металлический цинк. Цинк широко используется в промышленности, например, для производства литейных сплавов и в гальванических процессах.
Медь(II) сульфат - еще один пример соли, который может быть использован для электролиза. При электролизе медного(II) сульфата водного раствора, на катоде осаждается медь. Медь широко используется в электротехнике и других отраслях промышленности.
Также можно использовать другие соли, такие как никельсульфат, железного(II) хлорида и другие, в зависимости от конкретных потребностей и целей процесса электролиза. Важно выбрать соль, которая будет обеспечивать получение требуемого металла на катоде, а также обладать достаточной степенью растворимости в воде для эффективного проведения процесса.
Выбор подходящей соли для электролиза

Выбор подходящей соли для электролиза водного раствора имеет важное значение, поскольку от этого зависит качество и эффективность процесса. При выборе соли необходимо учитывать ряд факторов, включая химическую стабильность, растворимость, электропроводность и степень ионизации.
Химическая стабильность соли является ключевым фактором, поскольку она должна быть достаточно стабильной в водном растворе, чтобы не разлагаться под воздействием электрического тока. Растворимость также играет важную роль, поскольку соль должна быть достаточно растворимой, чтобы обеспечить эффективную проводимость электричества.
Электропроводность соли должна быть высокой, чтобы обеспечить достаточное количество ионов для проведения электрического тока. Кроме того, степень ионизации соли в водном растворе также важна, поскольку только ионы могут участвовать в электролизе и приводить к получению металла.
В зависимости от конкретной задачи, могут использоваться различные соли. Некоторые из них, такие как хлорид натрия (NaCl) или сернокислый медь (CuSO4), широко применяются в лаборатории и промышленности для получения металлов, таких как натрий или медь. Важно учитывать все вышеперечисленные факторы при выборе соли для электролиза, чтобы обеспечить оптимальные условия и получить желаемый результат.
Применение полученного металла

Металл, который можно получить электролизом водного раствора его соли, находит широкое применение в различных отраслях промышленности.
В электротехнике этот металл используется для создания проводников и контактов благодаря своей высокой электропроводности и устойчивости к окислению. Также он применяется в производстве батарей и аккумуляторов, обеспечивая их долговечность и высокую емкость.
В медицинской промышленности полученный металл используется для создания медицинских инструментов и имплантатов, так как он является биосовместимым и не вызывает аллергических реакций организма. Благодаря своей прочности он также используется в стоматологии для изготовления коронок и протезов.
В автомобильной промышленности полученный металл применяется для создания автомобильных деталей, таких как кузовные панели, рамы и их защитные покрытия. Благодаря своей легкости и прочности он позволяет уменьшить вес автомобиля и повысить его эффективность.
Также полученный металл может найти применение в аэрокосмической промышленности, где его высокая стойкость к экстремальным условиям и низкий вес позволяют создавать легкие и прочные компоненты для космических кораблей и спутников.
Вопрос-ответ

Какие материалы нужны для электролиза водного раствора металлической соли?
Для электролиза водного раствора металлической соли необходимы следующие материалы: вода, металлическая соль, два электрода (обычно из металла) и источник электрического тока.
Какой металл получается из электролиза водного раствора его соли?
Металл, который можно получить из электролиза водного раствора его соли, зависит от раствора. Например, если водный раствор содержит соль меди, то из него можно получить медь.
