Оксиды металлов являются сильными окислителями и часто проявляют активность в химических реакциях с различными веществами. Особый интерес вызывает их реакция с водой. В данной статье мы рассмотрим эту реакцию и ее особенности.
Взаимодействие оксидов металлов с водой обычно сопровождается выделением водорода и образованием основ. Однако, этот процесс может различаться в зависимости от свойств оксида и условий реакции.
Некоторые оксиды металлов, такие как оксид натрия или оксид калия, растворяются в воде без видимого образования газов и образуют щелочные растворы. В результате такой реакции оксид переходит в гидроксид металла, а вода действует как агент, обеспечивающий распад оксида на ионы.
Другие оксиды металлов, например оксид алюминия или оксид магния, не растворяются в воде, но взаимодействуют с ней посредством гидратации. При этом образуется гидроксид металла, который не растворяется, но образует осадок в виде гидратных частиц.
Оксиды металлов: свойства и реакция с водой
Оксиды металлов - это химические соединения, которые образуются в результате реакции металла с кислородом. Они имеют разнообразные свойства, но одной из наиболее распространенных характеристик оксидов металлов является их способность взаимодействовать с водой.
Реакция оксидов металлов с водой может быть как спокойной, так и бурной, в зависимости от свойств исходного вещества. Некоторые оксиды металлов не растворяются в воде и не реагируют с ней, например, оксид алюминия (Al2O3), который образует защитную пленку на поверхности и не дает воде проникать внутрь.
Однако большинство оксидов металлов реагируют с водой, выделяя при этом растворимые основания. Например, растворение оксида натрия (Na2O) в воде приводит к образованию щелочи - гидроксида натрия (NaOH). Эта реакция сопровождается выделением тепла и образованием гидроксида металла.
Еще одной характерной особенностью реакции оксидов металлов с водой является выделение водорода. Некоторые металлические оксиды, такие как оксид кальция (CaO) или оксид железа (Fe2O3), могут прореагировать с водой, выделяя при этом водород. Эти реакции характеризуются значительным выделением энергии и возможностью самовоспламенения газовой смеси.
Таким образом, реакция оксидов металлов с водой является важным аспектом их химических свойств. Она может приводить к образованию оснований или выделению водорода в зависимости от свойств исходного вещества. Эти реакции играют существенную роль в различных химических процессах и имеют практическое применение в таких отраслях, как строительство и промышленность.
Что такое оксиды металлов?

Оксиды металлов – это химические соединения, образующиеся при взаимодействии металлов с кислородом. Оксиды металлов широко распространены в природе и составляют значительную часть земной коры. Они являются одними из основных компонентовруд, из которых добывают металлы.
Оксиды металлов могут иметь различные формулы и свойства. Например, оксид железа имеет формулу Fe2O3 и является красным порошком, который известен под названием ржавчины. Оксиды металлов могут быть как растворимыми в воде, так и нерастворимыми.
Оксиды металлов обладают различными свойствами и применяются в разных сферах. Некоторые оксиды металлов используются в качестве красителей и пигментов, например, оксиды железа применяются для получения красных, желтых и черных пигментов. Другие оксиды металлов используются в качестве катализаторов в различных химических реакциях.
Оксиды металлов также являются важными компонентами при испытании взаимодействия металлов с водой. При контакте с водой некоторые оксиды металлов реагируют, выделяя водород и образуя соответствующие гидроксиды. Эти реакции являются одной из основ в химии и имеют практическое применение, например, в процессе получения водорода.
Свойства оксидов металлов
Оксиды металлов являются неорганическими соединениями, образованными из металла и кислорода. Они обладают рядом характерных свойств, которые делают их полезными в различных областях.
Химическая активность: Оксиды металлов обладают высокой химической активностью, что делает их реактивными веществами. Они способны взаимодействовать с другими соединениями и образовывать новые вещества.
Физические свойства: Оксиды металлов часто являются твердыми веществами, но некоторые могут быть жидкими или газообразными при определенных условиях. Они обладают высокой плотностью и температурой плавления.
Электропроводность: Некоторые оксиды металлов обладают электропроводностью и используются в качестве проводников электричества. Они могут быть использованы в различных электронных устройствах и системах.
Кислотные свойства: Некоторые оксиды металлов обладают кислотными свойствами и способны реагировать с водой, образуя гидроксиды. Это свойство может быть использовано в процессе очистки воды или в производстве химических реактивов.
Использование в промышленности: Оксиды металлов широко используются в различных отраслях промышленности, включая производство стекла, керамики, красителей и катализаторов. Они также играют важную роль в электронике и энергетике.
Обладая разными свойствами и химической активностью, оксиды металлов представляют широкий спектр возможностей для применения в различных областях и являются важными соединениями в химии.
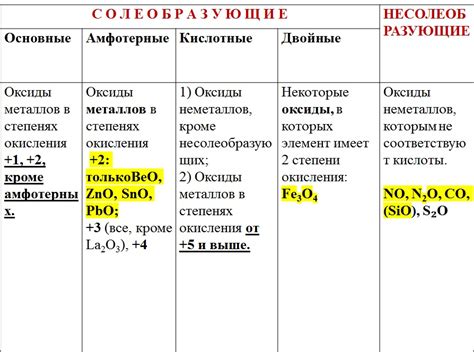
Классификация оксидов металлов
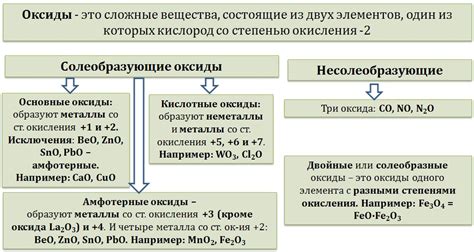
Оксиды металлов - это вещества, состоящие из атомов металла и кислорода. В зависимости от степени окисления металла и соотношения атомов металла и кислорода, оксиды металлов можно классифицировать.
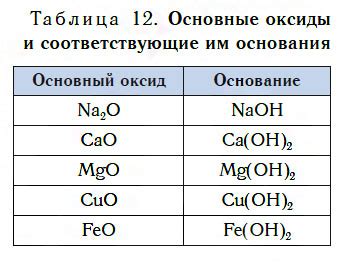
Первая группа оксидов - основные оксиды. Они образуются при взаимодействии щелочных металлов с кислородом. Основные оксиды обладают щелочными свойствами, растворяются в воде и образуют гидроксиды металлов.
Вторая группа оксидов - кислотные оксиды. Они образуются при взаимодействии неметаллов с кислородом. Кислотные оксиды образуют кислоты при растворении в воде или при взаимодействии с щелочами.
Третья группа оксидов - амфотерные оксиды. Они образуются при взаимодействии некоторых металлов с кислородом. Амфотерные оксиды могут проявлять кислотные или основные свойства в зависимости от условий реакции.
Четвертая группа оксидов - нейтральные оксиды. Они образуются при взаимодействии переходных металлов с кислородом. Нейтральные оксиды обладают нейтральными свойствами и не образуют ни кислоты, ни щелочи при растворении в воде.
Взаимодействие оксидов металлов с водой

Взаимодействие оксидов металлов с водой является одним из важных процессов в химических реакциях. Оксиды металлов представляют собой химические соединения, которые образуются в результате соединения металла с кислородом. При контакте с водой оксиды металлов могут проявлять различные свойства и происходить различные химические реакции.
Одной из наиболее известных реакций является образование оснований при взаимодействии оксидов металлов с водой. В результате таких реакций образуется сильное основание, которое может реагировать с кислотами и образовывать соль и воду. Также при взаимодействии оксидов металлов с водой может выделяться водород. Это явление характерно для металлов с небольшим электроотрицательностью.
Некоторые оксиды металлов с водой проявляют реакцию гидролиза. В результате этой реакции оксид металла расщепляется на ионы металла и гидроксид ион. Гидроксид ион может образовывать основания или слабые кислоты в зависимости от реакционных условий. Такие реакции широко применяются в промышленности и в производстве.
Взаимодействие оксидов металлов с водой может иметь различные последствия и результаты в зависимости от условий реакции и свойств оксида металла. Поэтому исследование данного процесса является важным для понимания химических свойств оксидов металлов и их применения в различных отраслях науки и промышленности.
Когда оксиды металлов реагируют с водой?

Оксиды металлов – это соединения, составленные из металлического элемента и кислорода. Некоторые из них могут реагировать с водой, образуя щелочи или кислоты, в зависимости от конкретного оксида.
Процесс взаимодействия оксидов металлов с водой называется гидратацией. При гидратации оксиды металлов могут проявлять различную активность. Некоторые металлы, такие как натрий и калий, реагируют с водой весьма энергично, выбрасывая водород и образуя щелочи. Другие металлы, например, оксид алюминия, реагируют с водой намного медленнее и образуют кислоту.
Температура также влияет на скорость реакции между оксидами металлов и водой. Некоторые реакции могут протекать только при повышенной температуре или под воздействием внешнего источника тепла. Однако можно найти и такие оксиды металлов, которые не реагируют с водой ни при каких условиях.
Важно отметить, что при гидратации оксидов металлов могут выделяться газы, в том числе водород. Это позволяет использовать реакцию оксидов металлов с водой для получения водорода – важного промышленного сырья. Также этот процесс имеет большое значение в экологических исследованиях, так как реакция оксидов с водой может влиять на качество водных экосистем.
Что происходит при реакции оксидов металлов с водой?

Реакция оксидов металлов с водой – это химическая взаимодействие, при котором оксид металла взаимодействует с водой, образуя гидроксид металла и выделяя водород. Эта реакция является типичной для большинства металлических оксидов и может иметь как экзотермический, так и эндотермический характер в зависимости от свойств конкретного оксида.
Обычно при реакции оксидов различных металлов с водой выделяется водород и образуется гидроксид металла. При этом оксид металла вступает в реакцию с молекулами воды, передавая им свой кислород и превращаясь в гидроксид. Образовавшийся в результате реакции гидроксид металла может быть растворимым или нерастворимым в воде, что определяет видимость образовавшейся реакции.
Интенсивность реакции оксида металла с водой зависит от ряда факторов, таких как активность металла, его окислительные свойства, температура, растворимость гидроксида металла и другие параметры. Существует целый ряд оксидов металлов, которые проявляют активность и взаимодействуют с водой даже при комнатной температуре, выделяя водород с существенной интенсивностью.
Реакция оксидов металлов с водой имеет свои практические применения. Например, процессы взаимодействия железных оксидов с водой используются в химической промышленности для получения водорода, который представляет собой важное сырье для многих отраслей промышленности и используется в качестве топлива, промышленных реагентов и других целей.
Реактивность оксидов металлов в реакции с водой
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Они могут быть различной степени окисления и имеют разную реактивность во взаимодействии с водой.
При взаимодействии некоторых оксидов металлов с водой происходят интенсивные химические реакции. Например, натрий оксид (Na2O) образует щелочное вещество, натриевую гидроксид, при контакте с водой. Эта реакция сопровождается выделением большого количества тепла и образованием гидроксида натрия (NaOH), который является сильной щелочью.
Другие оксиды металлов, например, оксиды переходных металлов, проявляют меньшую реактивность при взаимодействии с водой. Они могут образовывать слабые кислоты или нейтральные оксиды в результате реакции оксида с водой.
Также, стоит отметить, что не все оксиды металлов вступают в реакцию с водой. Некоторые оксиды металлов, особенно оксиды щелочноземельных металлов, такие как оксид кальция (CaO) или оксид магния (MgO), являются слабоскрывающимися и практически не реагируют с водой.
- Оксиды металлов могут иметь различную степень реактивности во взаимодействии с водой.
- Некоторые оксиды металлов образуют сильные основания при взаимодействии с водой, такие как щелочные гидроксиды.
- Оксиды переходных металлов могут образовывать слабые кислоты или нейтральные оксиды при взаимодействии с водой.
- Не все оксиды металлов реагируют с водой, некоторые из них являются практически нереактивными.
Практическое применение оксидов металлов и их реакция с водой

Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Они имеют широкое практическое применение в различных отраслях промышленности и технологии.
Оксиды металлов часто используются в качестве катализаторов в химических реакциях. Например, оксид меди (II) является эффективным катализатором в промышленном производстве метанола, а оксид цинка широко применяется в гетерогенных каталитических процессах.
Некоторые оксиды металлов обладают полупроводниковыми свойствами и используются в электронике и солнечной энергетике. Например, оксид кремния широко применяется в производстве солнечных батарей, а оксиды металлов группы III-IV (оксид бора, оксид индия и т.п.) используются в полупроводниковой электронике.
Важной особенностью многих оксидов металлов является их реакция с водой. Многие оксиды металлов реагируют с водой, образуя основания. Например, оксид натрия образует гидроксид натрия (щелочь), оксид кальция образует гидроксид кальция (известь). Эти реакции широко используются в жизни, например, при производстве щелочей и строительных растворов.
Суммируя, оксиды металлов имеют разнообразное практическое применение, включая использование в качестве катализаторов, полупроводников и оснований. Их реакция с водой является важным аспектом их химических свойств и находит применение в различных производственных процессах и технологиях.
Вопрос-ответ

Что такое оксиды металлов?
Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Они образуются при взаимодействии металла с кислородом.
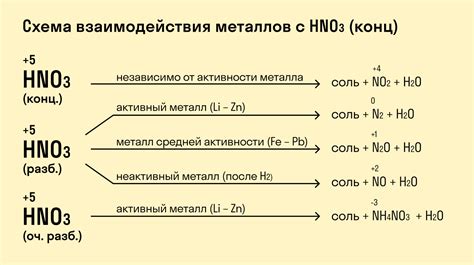
В чем заключается реакция оксидов металлов с водой?
Реакция оксидов металлов с водой заключается в том, что оксид металла реагирует с молекулой воды, образуя соответствующий гидроксид металла и высвобождая молекулы водорода.
Может ли реакция оксидов металлов с водой быть взрывоопасной?
Да, некоторые оксиды металлов могут реагировать с водой с такой силой, что происходит взрыв. Например, натрий и калий при контакте с водой прореагируют с огневзрывом.
Какие металлы реагируют с водой?
Реагируют с водой различные металлы, например натрий, калий, магний, алюминий. При реакции они образуют соответствующие гидроксиды металлов и высвобождаются молекулы водорода.
Каково значение реакции оксидов металлов с водой?
Реакция оксидов металлов с водой имеет большое значение в химической промышленности. Например, метод алюминотермии используется для получения алюминия. Реакция натрия с водой также используется для получения водорода.
