Металлы, такие как железо, алюминий, медь и многие другие, являются основными строительными блоками современных технологий и промышленности. Они обладают высокой электропроводностью, термической и химической стойкостью, что делает их незаменимыми для создания различных изделий и материалов.
Także również металлы могут реагировать с другими веществами, например, с оксидами металлов, чтобы образовать специфические соединения, называемые металлооксидами. Металлооксиды обладают уникальными свойствами, которые зависят от типа металла и его соединения с оксидом.
Формула металлооксида определяется выделением окислительного металлического элемента после знака "+" в формуле соединения. Например, FeO обозначает двухвалентное железо Fe, соединенное с кислородом. Различные формулы металлооксидов могут указывать на разные типы металлов и различные соединения металла с кислородом.
Примеры металлооксидов:
- Алюминий оксид (Al2O3): прочное и термически стойкое соединение, используется в производстве керамики и защитного покрытия для металлических поверхностей.
- Медный оксид (CuO): используется в электронике и для нанесения галогенированных покрытий на стекло.
- Железный оксид (Fe2O3): широко распространенное в природе вещество, известное как красная глина или красный песок.
Металл плюс оксид металла - это не только интересная комбинация химических элементов, но и основа для создания различных материалов с уникальными свойствами и применениями. Изучение металлооксидов помогает понять их роль в современных технологиях и научиться использовать их потенциал для достижения новых высот в различных отраслях промышленности и науки.
Металлы и оксиды металлов: обзор

Металлы - это класс элементов, обладающих хорошей проводимостью электричества и тепла, а также высокой пластичностью и прочностью. Они являются основными строительными блоками многих материалов и имеют широкое применение в промышленности и технологии.
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Они образуются при реакции металла с кислородом или его соединениями. Оксиды металлов могут иметь различные формулы и структуры, и их свойства сильно зависят от конкретного металла и его оксида.
Оксиды металлов имеют широкий спектр применений. Некоторые из них используются в качестве катализаторов, ускоряющих химические реакции. Некоторые оксиды металлов используются как пигменты в производстве красителей и красок. Другие оксиды металлов применяются в производстве электроники, стекол и керамики.
Одним из наиболее известных примеров оксидов металлов является оксид железа (III), он же гематит. Этот оксид металла имеет формулу Fe2O3 и обладает красной окраской. Гематит широко используется в производстве стали и в качестве красителя для красок и косметических средств.
Также стоит упомянуть оксид алюминия (алюминиевую глину), он имеет формулу Al2O3 и обладает высокой жаропрочностью и химической стойкостью. Алюминиевая глина используется в производстве керамики, огнеупорных материалов и абразивов.
В итоге, металлы и оксиды металлов являются важными компонентами современных технологий и материалов. Их сочетание позволяет создавать разнообразные функциональные материалы с уникальными свойствами.
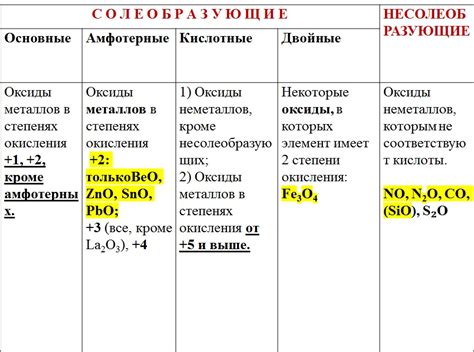
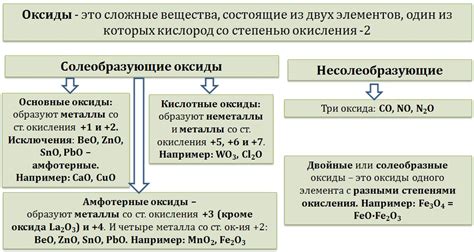
Формулы оксидов металлов
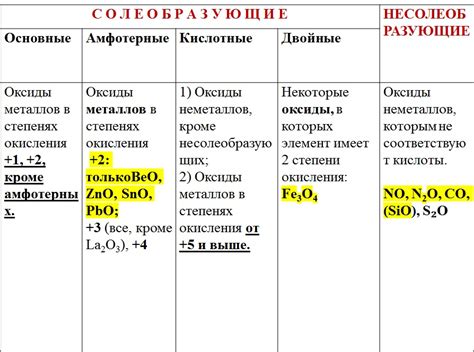
Оксиды металлов - это соединения, состоящие из металла и кислорода. Они образуются при реакции металла с кислородом или окислителями. Формулы оксидов металлов определяются их химическими элементами и соотношением атомов.
Одним из примеров оксида металла является оксид цинка (ZnO), который образуется при реакции цинка с кислородом. Его формула показывает, что в соединении содержится один атом цинка и один атом кислорода.
Другим примером является оксид железа (Fe2O3), который образуется при окислении железа. Его формула показывает, что в соединении содержится два атома железа и три атома кислорода.
Формулы оксидов металлов варьируются в зависимости от типа и количества металла и кислорода. Некоторые оксиды металлов могут иметь различные степени окисления, что отражается в их формулах. Например, у железа могут быть оксиды FeO и Fe3O4, которые содержат двухвалентное и железо с разными степенями окисления соответственно.
Важно отметить, что формулы оксидов металлов помогают определить состав соединений и их свойства. Оксиды металлов широко применяются в промышленности и науке, и изучение их формул и свойств имеет большое значение для понимания их химической природы и применения.
Химические свойства металлов в оксидах

Металлы обладают особыми химическими свойствами при взаимодействии с оксидами металлов. Они способны образовывать различные соединения и проявлять разные степени оксидации. При этом металлы могут выступать в роли окислителей или восстановителей.
В оксидах металлов металлические ионные связи играют важную роль. Они обеспечивают структурную целостность оксидов и влияют на их физические и химические свойства. Часто металлы образуют положительные ионы, которые формируют соединения с отрицательными ионами кислорода.
Многие металлы способны взаимодействовать с оксидами металлов при нагревании или действии кислорода. Например, цинк может реагировать с окислами металлов, образуя соли и освобождая кислород. Алюминий, в свою очередь, может образовывать соединения с кислородом, образуя оксид алюминия.
Оксиды металлов часто используются в различных производственных отраслях. Они могут применяться как катализаторы, оксиданты, стабилизаторы и другие вещества. Важным свойством оксидов металлов является их электрохимическая активность, которая определяет возможность использования этих веществ в различных электрохимических процессах.
Электрохимические свойства оксидов металлов
Оксиды металлов обладают уникальными электрохимическими свойствами, которые определяют их применение в различных областях науки и техники. Он включает в себя такие свойства, как электропроводность, реакционность и каталитические свойства.
Электропроводность является одной из важных характеристик оксидов металлов. Она определяется наличием свободных электронов в структуре оксида. Металлические оксиды, такие как оксид железа, оксид алюминия и оксид меди, являются отличными электропроводниками из-за наличия большого количества свободных электронов в их структуре. Такие оксиды металлов могут применяться в электронике, электрохимии и других областях, где требуется электрическая проводимость.
Реакционность - это способность оксидов металлов взаимодействовать с другими веществами и участвовать в химических реакциях. Оксиды металлов могут проявлять как окислительные, так и восстановительные свойства. Некоторые оксиды металлов, например оксид меди(II), оксид марганца(IV) и оксид кобальта(II), могут служить катализаторами в различных химических реакциях.
Каталитические свойства оксидов металлов делают их важными компонентами в каталитических процессах, которые используются в промышленности, лабораторных исследованиях и других отраслях. Эти оксиды способны активировать реагенты и ускорять химические реакции, без своего участия в самих реакциях. Каталитические оксиды металлов, такие как оксид палладия, оксид цинка и оксид титана, используются в производстве пластмасс, лекарств, катализаторов и многих других веществ.
Физические свойства оксидов металлов

Оксиды металлов - химические соединения металлов с кислородом, которые имеют широкий спектр физических свойств.
Они обладают различными цветами: некоторые оксиды металлов ярко окрашены, например, красный или синий, в то время как другие оксиды металлов могут быть безцветными или иметь бледный оттенок.
Другим важным физическим свойством оксидов металлов является их плотность. Она может сильно варьировать в зависимости от типа металла и его соединения с кислородом.
Оксиды металлов обычно обладают высокой температурой плавления и кипения, что делает их незаменимыми для использования в высокотемпературных процессах, таких как производство стекла или выработка металлургических сплавов.
Также, оксиды металлов могут иметь проводящие свойства, что делает их полезными в электронике и производстве полупроводников. Запомните, что свойства оксидов металлов могут сильно различаться в зависимости от сочетания металла и кислорода, поэтому их изучение требует детального анализа каждого отдельного соединения.
Примеры важных оксидов металлов

Оксиды металлов являются важными соединениями, которые имеют широкое применение в различных областях. Вот несколько примеров важных оксидов металлов:
- Оксид железа (III) (Fe2O3), также известный как гематит, является одним из самых распространенных оксидов металлов. Он обладает красно-коричневой окраской и широко используется в производстве стекла и керамики.
- Оксид алюминия (Al2O3), называемый также алюминием, является основным компонентом бокситовых руд, которые являются основой для производства алюминия. Он обладает высокой термической и химической стойкостью и широко используется в промышленности.
- Оксид цинка (ZnO) имеет широкий спектр применения. Он используется в производстве резин, керамики, лаков и пигментов, а также в солнцезащитных кремах и лекарственных препаратах.
- Оксид меди (II) (CuO) является одним из главных оксидов меди. Он используется в качестве катализатора, пигмента и в производстве электронных компонентов.
- Оксид азота (II) (NO2) является одним из оксидов азота и важным компонентом атмосферного загрязнения. Он образуется в результате сжигания топлива и может вызывать проблемы со здоровьем при вдыхании.
Это лишь некоторые примеры важных оксидов металлов. Оксиды металлов имеют разнообразные свойства и находят применение во многих отраслях промышленности и науки.
Применение оксидов металлов
Оксиды металлов имеют широкое применение в различных областях науки и промышленности. Они используются как катализаторы, материалы для производства электродов, а также как добавки в различных материалах и покрытиях.
Катализаторы на основе оксидов металлов применяются в химической промышленности для ускорения химических реакций. Например, оксид железа (Fe2O3) используется в качестве катализатора при производстве аммиака.
Оксиды металлов также применяются в производстве электродов для аккумуляторов и топливных элементов. Например, оксид цинка (ZnO) используется в качестве материала для электродов в аккумуляторах.
Некоторые оксиды металлов имеют специфические свойства, которые позволяют использовать их в различных областях. Например, оксид олова (SnO2) имеет свойство обладать высокой прозрачностью для видимого света и одновременно низким сопротивлением, поэтому он широко применяется в производстве тонких пленок для солнечных батарей и жидкокристаллических дисплеев.
В области строительства оксиды металлов используются в производстве красок, лаков и пигментов, которые служат для окрашивания различных поверхностей. Например, оксид железа (Fe2O3) используется в производстве красных и коричневых пигментов для окрашивания кирпича и керамической плитки.
Также оксиды металлов используются в производстве катализаторов для автомобильных выхлопных систем, в производстве стекол, керамики и электроники. Их применение постоянно расширяется и развивается вместе с развитием науки и технологий.
Вопрос-ответ

Какие формулы образуются при соединении металла с оксидом металла?
При соединении металла с оксидом металла образуются различные формулы, в зависимости от сочетания металла и оксида. Например, для соединения металла M с оксидом металла M2O образуется формула MO, а для соединения металла M с оксидом металла MO2 - формула M2O.
Какие свойства обладают соединения металлов с оксидами металлов?
Соединения металлов с оксидами металлов обладают различными свойствами. Они могут быть твердыми или жидкими веществами, иметь различную степень растворимости в воде, быть кислотными или основными оксидами. Кроме того, такие соединения могут обладать проводимостью электрического тока, иметь специфические цвета и т.д.
Какими примерами соединений металлов с оксидами металлов можно привести?
В качестве примеров соединений металлов с оксидами металлов можно привести следующие вещества: оксид железа Fe2O3 (ружья), оксид алюминия Al2O3 (корунд), оксид меди Cu2O (оксид меди(I)), оксид цинка ZnO (цинковый оксид) и другие.
Какие основные свойства проявляются у соединений металлов с оксидами металлов?
У соединений металлов с оксидами металлов проявляются следующие основные свойства: высокая температура плавления и кипения, твердость, способность проводить электрический ток в расплавленном или растворенном состоянии, химическая устойчивость и способность к кислородной активности.
