В химии и физике существует много реакций, связанных с взаимодействием различных веществ. Одной из таких реакций является взаимодействие металлов с кислотными остатками. Такой процесс происходит, когда металлический элемент и кислотные остатки вступают в химическую реакцию, в результате чего образуется новое вещество и выделяется энергия.
Металлы, как правило, являются хорошими веществами для реакции с кислотными остатками. Они имеют свободные электроны, которые могут передаваться кислотным остаткам и образовывать ионные связи. Когда металл вступает в контакт с кислотными остатками, происходит отдача электронов, что приводит к окислению металла и восстановлению кислотных остатков.
Реакция металла с кислотными остатками может быть сопровождена выделением газа, например, водорода, или образованием раствора с солевыми остатками. Такие реакции могут быть проведены в лабораторных условиях и имеют практическое применение в различных отраслях промышленности.
Знание о реакциях металлов с кислотными остатками позволяет ученым и инженерам расширять границы научных и технологических достижений в области материалов и энергии.
Исследование таких реакций важно для понимания фундаментальных законов химии и физики, а также для разработки новых материалов и процессов, которые могут быть использованы в промышленности и науке. Помимо этого, реакции металлов с кислотными остатками являются частью ежедневной жизни, ведь мы ежедневно используем металлические изделия и сталкиваемся с различными химическими веществами.
Металл и кислотный остаток: взаимодействие и реакция

Металлы и кислотные остатки - это два типа веществ, которые могут взаимодействовать друг с другом и генерировать химические реакции. Металлы обладают способностью давать электроны, тогда как кислотные остатки, такие как гидроксиды, сульфаты или нитраты, могут принимать электроны от металла. Это взаимодействие часто приводит к образованию солей и обмену ионами.
Когда металл контактирует с кислотным остатком, происходит окислительно-восстановительная реакция. Металл отдает свои электроны кислотным остаткам, что приводит к окислению металла, а кислотные остатки принимают эти электроны и восстанавливаются. Это также может вызывать отделение газов, если вещество обладает этим свойством.
Примером такого взаимодействия является реакция между цинком и серной кислотой. В этой реакции цинк отдает два электрона серной кислоте, образуя ион цинка и серный ион. Отделение водорода приводит к образованию пузырьков и характерного звука. Этот процесс можно описать уравнением:
- Zn + H2SO4 -> ZnSO4 + H2
Такие реакции имеют широкий спектр применения в различных областях, включая промышленность и научные исследования. Они позволяют получать различные продукты и использовать их в процессах производства.
Что такое металл и кислотный остаток?
Металл - это химический элемент, классифицируемый как твердое вещество и обладающий хорошей теплопроводностью и электропроводностью. Металлы характеризуются своей относительной пластичностью и определенными физическими свойствами, такими как металлический блеск и способность образовывать ионные соединения.
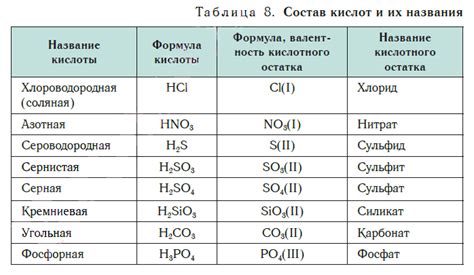
Кислотный остаток - это часть молекулы кислоты, которая остается после отщепления одного или нескольких водородных ионов. Кислотные остатки имеют заряд, который может быть положительным или отрицательным, в зависимости от того, является ли кислота слабой или сильной. Эти остатки являются основными строительными блоками для образования солей и многих других химических соединений.
Когда металл и кислотный остаток встречаются, происходит химическая реакция, называемая взаимодействием металла с кислотой. Во время этой реакции ионы металла и ионы кислотного остатка обмениваются, образуя новые соединения. Обычно при таком взаимодействии образуются соли и выделяется вода.
Примером такого взаимодействия является реакция между металлом натрием (Na) и кислотой соляной (HCl). При их смешивании образуются ионы натрия (Na+) и ионы хлорида (Cl-), и образуется соль натрия (NaCl), а также выделяется вода (H2O).
Взаимодействие металлов с кислотными остатками имеет различные практические применения. Например, это может быть использовано в процессе очистки металлических поверхностей от коррозии, а также в процессе получения солей и других химических соединений в промышленности и лаборатории.
Почему металлы и кислоты реагируют друг с другом?

Реакция металлов с кислотами является одной из основных химических реакций, которая происходит из-за сильной электроотрицательности атомов кислорода и водорода в молекуле кислоты. Когда металл контактирует с кислотой, происходит обмен ионами, что приводит к образованию соли и выделению водорода.
Когда металл и кислота взаимодействуют, происходит реакция окисления металла и восстановления атомов кислорода в кислоте. Металл отдает электроны атомам кислорода, в результате чего атомы кислорода превращаются в отрицательные ионы оксидов. Металл же становится положительным ионом, образуя соль.
Металлы и кислоты могут взаимодействовать только при определенных условиях: необходимо наличие свободных и незащищенных участков на поверхности металла для контакта с кислотой, а также активность кислоты должна быть достаточно высокой. В зависимости от свойств металла и кислоты, реакция может происходить с разной интенсивностью и скоростью.
Реакция металлов с кислотами имеет широкое применение в различных областях, включая производство химических реагентов, металлообработку и даже в жизни человека – в нашем желудке соляная кислота помогает переваривать пищу. Знание и понимание этой реакции позволяет улучшить процессы производства и разработать новые материалы и технологии.
Как происходит реакция между металлом и кислотным остатком?

Реакция между металлом и кислотным остатком является химической реакцией, которая происходит при контакте металла с раствором кислоты или кислотным остатком. В результате этой реакции происходит образование солей металла и выделение водорода.
Процесс реакции между металлом и кислотным остатком начинается с разложения кислоты на ионы водорода и ионы кислотного остатка. Далее ионы кислотного остатка взаимодействуют с поверхностью металла, что приводит к образованию соли металла и выделению водорода.
При этой реакции активность металла играет важную роль. Некоторые металлы, такие как натрий или калий, реагируют с кислотным остатком очень быстро и интенсивно, выделяя большое количество водорода и разогревая раствор. Другие металлы, такие как медь или серебро, реагируют медленно или вовсе не реагируют с кислотными остатками.
Эта реакция является важной в химии и применяется в различных промышленных процессах, таких как производство водорода или очистка металлических поверхностей от окислов и загрязнений.
Как формируются новые соединения при реакции металла с кислотным остатком?
Когда металл вступает в реакцию с кислотным остатком, происходит обмен ионами между этими веществами. Металл отдает свои электроны в кислотный остаток, который в свою очередь становится отрицательно заряженным.
При этом образуется положительно заряженный ион металла, который соединяется с отрицательно заряженным ионом кислорода или кислотного остатка, образуя новое соединение. В результате образования нового соединения, металл теряет свою характеристику и становится частью нового химического вещества.
Стоит отметить, что при реакции металла с кислотным остатком происходит не только образование новых соединений, но и выделение газа в виде пузырьков. Это связано с тем, что в результате обмена ионами, образуются газообразные вещества, которые выделяются из раствора.
Высвобождающийся при реакции газ может быть использован для определения наличия металла или для определения его количественного содержания. Также реакция металла с кислотным остатком может сопровождаться выделением тепла, что является признаком химической реакции.
Какое значение имеет реакция между металлом и кислотным остатком в промышленности?

В промышленности реакция между металлом и кислотным остатком имеет огромное значение, поскольку она позволяет получить ценные продукты и материалы, а также улучшить процессы производства. Кислотные остатки, такие как серная, соляная или азотная кислоты, позволяют эффективно обрабатывать различные виды металлов и получать новые продукты с улучшенными свойствами.
Реакция между металлом и кислотным остатком может использоваться для очистки металлов от примесей и окисленных слоев, что улучшает их качество и повышает степень чистоты. Также эта реакция может быть использована для получения ценных продуктов, таких как соли металлов, которые находят применение в различных отраслях промышленности.
Важной областью применения реакции между металлом и кислотным остатком является производство гальванических покрытий. При этом методе покрытия металл подвергается взаимодействию с кислотным раствором, что позволяет создавать защитные и декоративные покрытия различной толщины и характеристик. Такие покрытия применяются в автомобильной, электронной и других отраслях промышленности для защиты металлических изделий от коррозии, повышения их стойкости к истиранию и улучшения их внешнего вида.
Кроме того, реакция между металлом и кислотным остатком может быть использована для получения энергии. Например, водородное топливо, которое является одним из ключевых источников возобновляемой энергии, может быть получено путем реакции металла с кислотным раствором. Этот процесс, известный как гидрохимическая реакция, позволяет получать чистый водород, который может быть использован в различных отраслях промышленности и транспорта.
Как металлы реагируют с различными видами кислотных остатков?

Металлы имеют способность реагировать с различными кислотными остатками и образовывать с ними соединения. Это происходит из-за их химической активности и электрохимических свойств. Реакция металла с кислотным остатком может приводить к образованию соли и выделению газа.
Когда металл взаимодействует с кислотным остатком, происходит обмен ионами. Ионы металла замещают ионы водорода в кислотных остатках, образуя соль. Некоторые металлы, такие как натрий и калий, реагируют с кислотными остатками очень активно и могут вызывать сильное выделение газа.
В зависимости от типа кислотного остатка, металлы могут реагировать по-разному. Например, с марганцевым кислотным остатком могут реагировать алюминий, цинк и магний, образуя соли. Серная кислота обычно реагирует с металлами, такими как железо и медь, образуя соответствующие сульфаты.
Некоторые металлы образуют пассивную оксидационную пленку на своей поверхности, которая защищает их от дальнейшей реакции с кислотными остатками. Однако, некоторые кислотные остатки могут проникать через эту пленку и вызывать коррозию металла.
В целом, реакция металлов с различными кислотными остатками является важным процессом в химии и применяется в различных областях, таких как производство металлов, а также в химической и фармацевтической промышленности.
Какие виды металлов наиболее активно реагируют с кислотными остатками?

Металлы отличаются своей активностью в реакции с кислотными остатками и способностью образовывать с ними соединения. Некоторые металлы проявляют высокую активность и могут реагировать с различными кислотными остатками.
Один из самых активных металлов - это щелочные металлы, такие как натрий (Na), калий (K) и литий (Li). Они образуют сильные щелочные гидроксиды в реакции с водными растворами кислотных остатков.
Также реактивными с кислотными остатками являются щелочноземельные металлы, такие как магний (Mg) и кальций (Ca). Они реагируют с кислотными остатками, образуя гидроксиды и соли щелочноземельных металлов.
Некоторые переходные металлы, такие как железо (Fe), цинк (Zn) и алюминий (Al), также образуют реакционные соединения с кислотными остатками. Например, железо реагирует с серной кислотой, образуя сульфат железа.
Важно отметить, что степень реактивности металлов с кислотными остатками может также зависеть от концентрации и характера используемой кислоты, а также от условий реакции.
Важность регулирования реакции между металлом и кислотным остатком в химической промышленности

Регулирование реакции между металлом и кислотным остатком является неотъемлемой частью химической промышленности и играет ключевую роль в процессе производства металлических материалов и изделий.
Металл плюс кислотный остаток может привести к образованию газов, нагреванию, коррозии, растворению или окислению металла. Для предотвращения негативных последствий необходимо тщательно контролировать и регулировать эту реакцию.
Один из основных методов регулирования реакции между металлом и кислотным остатком - выбор правильной кислоты и их концентрации. Концентрация кислоты может влиять на скорость реакции и интенсивность образования газов или коррозии. Правильный выбор кислоты и ее концентрации позволяет достичь желаемых результатов и минимизировать риск повреждений металлических материалов.
Дополнительным методом регулирования реакции металла и кислотного остатка является изменение температуры процесса. Температура может влиять на скорость реакции и химические свойства образующихся соединений. Поддержание оптимальной температуры позволяет контролировать процесс взаимодействия металла с кислотным остатком и достичь желаемых химических и физических свойств металлических изделий.
Для контроля и регулирования реакции металла с кислотным остатком используются специализированные оборудование и процессы. Некоторые предприятия используют автоматические системы контроля и регулирования, которые обеспечивают оптимальные условия производства и минимизируют риск отрицательных последствий реакции. Системы мониторинга и контроля позволяют операторам быстро реагировать на изменения в процессе и принимать соответствующие меры.
В целом, регулирование реакции между металлом и кислотным остатком является критическим аспектом химической промышленности и существенно влияет на качество, безопасность и эффективность процесса производства металлических материалов и изделий.
Вопрос-ответ

Какое значение имеет кислотный остаток?
Кислотный остаток - это остаток кислоты после ее реакции с другим веществом. Он может иметь различное значение в зависимости от конкретной ситуации. В некоторых случаях кислотные остатки имеют высокую токсичность и могут быть опасны для окружающей среды и здоровья человека. В других случаях они могут быть использованы для получения новых веществ или в процессе испытания качества материалов.
Как происходит реакция металла с кислотным остатком?
Когда металл вступает в реакцию с кислотным остатком, происходит химическая реакция, называемая реакцией металла с кислотой. В результате этой реакции образуется соль металла и водород. Например, реакция цинка с серной кислотой приводит к образованию сульфата цинка и выделению молекул водорода. Данная реакция может иметь различные приложения, от получения нужной соли до генерации водорода для энергетических целей.
В чем заключается практическое применение металлов в реакции с кислотными остатками?
Металлы могут использоваться для различных практических целей в реакции с кислотными остатками. Например, алюминий широко применяется в процессе очистки воды от кислотных остатков. Алюминий реагирует с фосфатами и сульфатами, образуя инертные осадки, которые можно легко удалить из воды. Другой пример - использование железа в процессе удаления сульфатов из промышленных сточных вод. Железо реагирует с сульфатными ионообменными смолами, образуя сульфат железа и очищая воду от сульфатных остатков.
