Взаимодействие металлов с основами и кислотами является основой химических реакций, которые мы наблюдаем в повседневной жизни. Металлы как активные элементы имеют способность реагировать со многими веществами, включая основы и кислоты. Эти реакции происходят с образованием новых веществ и сопровождаются выделением или поглощением энергии.
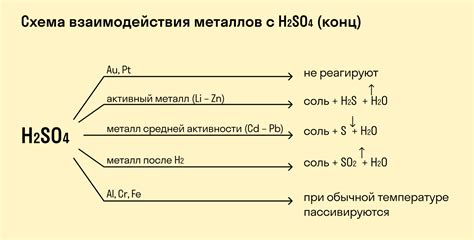
Взаимодействие металлов с кислотами является реакцией окисления-восстановления, которая протекает с образованием соли и выделением водорода. В зависимости от химической активности металла и концентрации кислоты, реакция может протекать с различной интенсивностью. Некоторые металлы, такие как железо, реагируют со сильными кислотами, например, соляной, алюминий реагирует только с концентрированными кислотами, а золото и платина не реагируют с кислотами вообще.
Взаимодействие металлов с основами также происходит с образованием солей, но без выделения водорода. Каждый металл обладает характерными свойствами, которые определяют его способность реагировать с основами. Например, алюминий образует соли с гидроксидом натрия, калия и другими щелочами, а золото не реагирует с основами.
Металлы и их реакция с основами

Металлы - это элементы, обладающие хорошей проводимостью электрического тока и тепла. Они играют важную роль в промышленности и являются неотъемлемой частью нашей повседневной жизни.
Один из способов взаимодействия металлов с веществами - это их реакция с основами. Основы - это химические соединения, которые, в растворе, обладают щелочными свойствами. При контакте металлов с основами может происходить реакция, в результате которой образуются соли и выделяется водород.
Например, реакция между металлом натрием и основой гидроксидом натрия может быть представлена уравнением: 2Na + 2NaOH → 2Na2O + H2↑. В результате этой реакции образуется соль натрия и выделяется водород.
Кроме натрия, с основами могут реагировать и другие металлы, такие как калий, магний, кальций и другие. При этом их реакционная способность будет зависеть от их электрохимического потенциала. Металлы, обладающие большим отрицательным потенциалом, будут более активными и сильнее реагировать с основами.
Реакция металлов с основами может проявляться в разных условиях. Например, в присутствии влаги, при нагревании или при использовании специальных катализаторов. Такие реакции широко используются в промышленности и научных исследованиях для получения различных химических соединений и производства различных продуктов.
Реакция металлов с кислотами

Реакция металлов с кислотами является одним из основных проявлений химического взаимодействия между различными веществами. Кислоты обладают кислотными свойствами и могут отдавать протоны, тогда как металлы, как правило, являются хорошими восстановителями.
При взаимодействии металлов с кислотами образуется соль и выделяется водород. Такая реакция называется реакцией нейтрализации. В результате этой реакции металлы электрохимически преобразуются, а кислоты теряют свои кислотные свойства.
Скорость реакции металлов с кислотами зависит от ряда факторов, таких как концентрация кислоты, температура, поверхность металла и его активность. Например, активные металлы, такие как натрий или калий, реагируют сильнее и быстрее, чем менее активные металлы.
Реакция металлов с кислотами широко используется на практике. Например, металлы активно применяются в производстве водорода, который используется в водородных топливных элементах или в качестве химического вещества во многих процессах. Кроме того, реакция металлов с кислотами используется для получения солей, которые находят применение в различных отраслях промышленности и сельском хозяйстве.
Химический состав основ и их взаимодействие с металлами
Основы - это химические соединения, обладающие щелочными свойствами. Они образуются при соединении металлов с гидроксидами, оксидами или карбонатами. Главные компоненты основ - металл и группа гидроксильных ионов (OH-).
Основы реактивны и способны вступать в химическую реакцию с различными веществами, включая металлы. При взаимодействии основ с металлами происходит образование солей металлов и протекание реакции обмена. Результатом данного процесса может быть выделение водорода или образование новых соединений.
Металлы различных групп могут реагировать с основами по-разному. В таких реакциях важную роль играют свойства металлов, такие как активность и электроотрицательность. Например, щелочные металлы (натрий, калий) активно реагируют с водной средой, образуя щелочи и выделяя при этом водород:
- 2Na + 2H2O = 2NaOH + H2 (натрий + вода = щелочь натрия + водород)
- 2K + 2H2O = 2KOH + H2 (калий + вода = щелочь калия + водород)
В то же время, некоторые металлы, например, медь, не вступают в реакцию с водой или образуют нестабильные соединения, поэтому их взаимодействие с основами ограничено.
Также важно отметить, что взаимодействие основ с металлами может протекать не только в водной среде, но и при воздействии основных растворителей, таких как спирты или аммиак. Это открывает новые возможности для использования основ в различных химических процессах и технологиях, включая промышленность, медицину и научные исследования.
Реакции кислот с металлами: уравнение и последствия
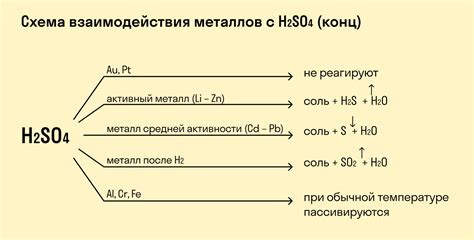
Реакции кислот с металлами происходят при соприкосновении кислоты с металлическим материалом. В результате этого взаимодействия образуются соли и выделяется водород. Уравнение реакции кислоты с металлом состоит из взаимодействия ионов кислоты с ионами металла.
Уравнение такой реакции имеет общий вид: кислота + металл → соль + водород. Например, реакция соляной кислоты с металлическим алюминием: 2HCl + 2Al → 2AlCl3 + H2. В данном случае соляная кислота взаимодействует с алюминием, образуется соль алюминия и выделяется водородный газ.
В результате реакции кислоты с металлом может наблюдаться не только выделение водорода, но и изменение цвета реагентов, появление пены или пузырьков, а также нагрев реакционной смеси. Последствия таких реакций могут быть разными, в зависимости от свойств кислоты и металла. Некоторые металлы, например, магний или цинк, реагируют крайне быстро и выделение водорода происходит в виде пузырьков, что делает реакцию заметной и даже впечатляющей. Важно также помнить, что реакции кислот с некоторыми металлами могут быть опасными или даже взрывными, поэтому необходимо соблюдать осторожность при проведении таких экспериментов.
Такие реакции имеют множество промышленных и практических применений. Например, реакция соляной кислоты с железом применяется для получения хлорида железа, который используется в процессе обработки стали. Кроме того, реакция металлов с кислотами широко используется в химических анализах, образовании лабораторных пузырьков, а также в обучении и демонстрации химических экспериментов.
Вопрос-ответ

Что такое взаимодействие металлов с основами и кислотами?
Взаимодействие металлов с основами и кислотами - это процессы, при которых металлы реагируют с основами (щелочами) и кислотами, образуя соответствующие соли и выделяя водород.
Какие реакции могут происходить при взаимодействии металлов с основами?
При взаимодействии металлов с основами может происходить реакция дисплазии (замещения), когда металл замещает водород в молекуле основы, образуя соль и выделяя водород. Например, реакция цинка с щелочью: Zn + 2NaOH → Na2ZnO2 + H2.
Какие реакции могут происходить при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами может происходить реакция образования соли и выделения водорода. Например, реакция железа с соляной кислотой: Fe + 2HCl → FeCl2 + H2.
Какие факторы влияют на скорость реакции взаимодействия металлов с основами и кислотами?
На скорость реакции взаимодействия металлов с основами и кислотами влияют такие факторы, как вид металла и его активность, концентрация основы или кислоты, температура, поверхность металла и наличие катализаторов.
Какая роль играют катионы в реакции взаимодействия металлов с основами и кислотами?
Катионы, которые образуются при реакции взаимодействия металлов с основами и кислотами, являются составной частью солей, которые образуются в результате реакции. Они определяют свойства и характер соли.
