Металлы - это элементы химической системы, которые обладают отличной проводимостью тепла и электричества, а также имеют ярко выраженные металлические свойства, такие как блеск и устойчивость к деформации. Однако металлические свойства могут быть изменены, когда металлы образуют соединения с галогенами.
Галогениды металлов - это соединения, образованные между металлом и одним из элементов группы галогенов, таких как фтор, хлор, бром или йод. Эти соединения могут быть стойкими и обладать различными свойствами, зависящими от выбранного галогена и металла.
Стойкость галогенидов металлов объясняется химической структурой этих соединений. Галоген представляет собой элемент из группы с высокой электроотрицательностью, что позволяет ему занимать отрицательный заряд в молекуле галогенида металла. Металл же обладает низкой электроотрицательностью, что позволяет ему занимать положительный заряд в молекуле.
Полученные таким образом молекулы галогенида металла стабильны и могут сохранять свои свойства в широком диапазоне условий, включая высокие температуры и экстремальные внешние воздействия. Более того, галогениды металлов могут обладать различными цветами, что делает их интересными для использования в различных областях науки и технологий.
Металлы, образующие стойкие галогениды

Металлы являются важными элементами в химии и промышленности. Некоторые из них могут образовывать стойкие галогениды, то есть соединения с галогенами, такими как фтор, хлор, бром или йод.
Одним из таких металлов является натрий. Он обладает устойчивым соединением с хлором, образуя соль натрия и хлора - хлористый натрий. Это одно из основных соединений, используемых в пищевой промышленности и в домашних условиях для соления и консервирования продуктов.
Еще одним примером металла, образующего стойкие галогениды, является калий. Он формирует соединение с йодом, называемое йодидом калия. Йодид калия широко используется в медицине, например, для профилактики йододефицитных состояний.
Алюминий также образует стойкие галогениды. Самым известным из них является хлорид алюминия, который широко используется в аналитической химии, производстве фармацевтических препаратов и как катализатор в органическом синтезе.
Образование стойких галогенидов металлов является важным фактором в их использовании в различных отраслях промышленности. Эти соединения обладают высокой стабильностью и широким спектром применения, что делает металлы ценными материалами в химической промышленности.
Что такое галогениды?
Галогениды - это класс химических соединений, образованных металлами и галогенами. Галогены включают в себя фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At). Возможно образование галогенидов различных металлов, таких как кальций (Ca), натрий (Na), цинк (Zn) и другие.
Галогениды обладают определенными свойствами, которые делают их очень полезными. Они обычно образуют кристаллические соединения с высокой теплостойкостью и стойкостью к окислению. Это делает их применимыми в различных областях, таких как производство стекла и керамики, электроника и фотография.
Галогениды проявляют интересные свойства, которые проявляются при взаимодействии с другими веществами. Например, некоторые галогениды могут быть использованы в реакциях фотолиза, при которых они разлагаются под воздействием света. Это свойство может быть использовано для получения атомарного галогена из галогенида.
Галогениды также широко используются в производстве пластмасс, резиновых изделий и красителей. Они могут использоваться в качестве катализаторов в химических реакциях или в качестве ингредиентов в фармацевтической и косметической промышленности. Благодаря своей химической реактивности, галогениды могут быть использованы для синтеза различных соединений, что делает их необходимыми в химической промышленности.
Особенности образования галогенидов металлами
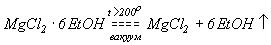
Металлы обладают особым свойством образовывать стойкие галогениды, что делает их важными и широко используемыми в различных отраслях науки и промышленности. Галогениды металлов являются соединениями металлов с галогенами (фтором, хлором, бромом и йодом) и обладают рядом уникальных свойств и химических реакций.
Основными особенностями образования галогенидов металлами является их высокая степень стабильности и устойчивости. Благодаря сильным химическим связям, образующимся между металлами и галогенами, галогениды металлов не подвержены легкому разрушению или разложению под воздействием внешних факторов, таких как температура, давление или влажность. Это позволяет использовать галогениды металлов в широком спектре применений.
Еще одной особенностью образования галогенидов металлами является их реакционная способность. Галогениды металлов могут участвовать в различных химических реакциях, таких как реакции замещения, окисления или восстановления. Это делает их важными компонентами в процессах получения других соединений или материалов.
Также стоит отметить, что образование галогенидов металлами может происходить при различных условиях. В зависимости от свойств металла и галогена, температуры, давления и других факторов, образующиеся галогениды металлов могут иметь различную структуру и свойства. Это дает возможность контролировать процесс образования галогенидов металлами и получать материалы с нужными характеристиками.
В целом, образование галогенидов металлами является важным фактором, определяющим их свойства и применение. Сочетание стойкости, реакционной способности и возможности контроля процессов образования позволяет использовать галогениды металлов в различных областях науки, технологии и промышленности.
Примеры стойких галогенидов металлов
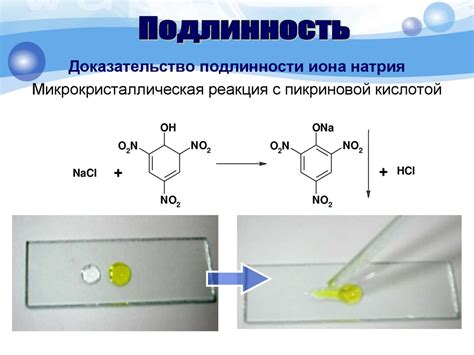
Металлы способны образовывать различные химические соединения с галогенами - элементами группы 17 периодической системы. Некоторые из этих соединений являются стойкими галогенидами, то есть обладают высокой устойчивостью и широкими областями применения.
Примером стойкого галогенида металла является хлорид железа (III) - соединение железа с хлором. Хлорид железа (III) образуется при взаимодействии трехвалентного железа со взвешенным хлором. Этот соединение обладает высокой устойчивостью и применяется в разных областях, включая фармацевтику и катализ химических реакций.
Еще одним примером стойкого галогенида металла является бромид меди (II) - соединение меди с бромом. Бромид меди (II) образуется при взаимодействии двухвалентной меди с бромом. Этот соединение обладает высокой температурной и химической устойчивостью и используется в производстве электроники и фотографии.
Алюминий образует стойкий галогенид в виде хлорида алюминия. Хлорид алюминия образуется при взаимодействии алюминия с хлорным газом. Данный соединение характеризуется высокой устойчивостью и широким спектром применения, включая использование в производстве лекарств и катализе.
Эти примеры лишь небольшая часть стойких галогенидов металлов, которые находят применение в разных областях. Металлы обладают разнообразием химических свойств, что позволяет им образовывать соединения с галогенами, стабильные и полезные в разных отраслях науки и промышленности.
Практическое применение галогенидов металлов
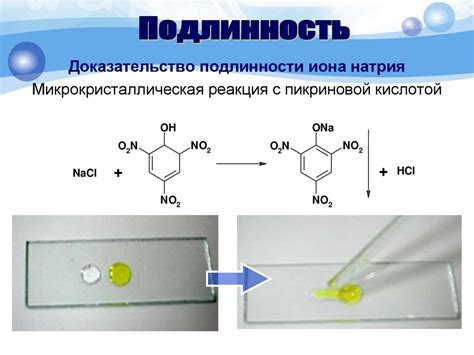
Галогениды металлов - это соединения, состоящие из металла и атомов галогенов (фтора, хлора, брома, йода). Их устойчивость и разнообразие свойств делает их важными в различных практических областях.
Одно из практических применений галогенидов металлов - это использование их в процессе обработки металлических поверхностей. Различные галогениды металлов могут быть использованы как катализаторы при проведении химических реакций, улучшая скорость реакции и повышая степень превращения исходных веществ. Это особенно полезно в процессе производства стальных изделий, где галогениды металлов могут использоваться для улучшения физических и механических свойств материала.
Галогениды металлов также широко применяются в электронике. Они могут быть использованы для создания полупроводниковых материалов, которые являются ключевыми компонентами в производстве полупроводниковых приборов, таких как транзисторы и солнечные панели. Галогениды металлов способны создавать сильную связь с полупроводниковыми материалами, улучшая их проводимость и электрические свойства.
Кроме того, галогениды металлов можно использовать в процессах осветления и покраски. Некоторые галогениды металлов обладают яркими цветами, их добавление в краски может придать им особенные оттенки и эффекты. Например, галогениды металлов могут использоваться для создания голубых и зеленых оттенков в стекле или керамике. Они также могут использоваться для окрашивания волос в яркие цвета.
В целом, галогениды металлов играют важную роль в различных отраслях, таких как химическая и металлургическая промышленность, электроника и производство красок. Их уникальные свойства делают их неотъемлемыми компонентами в многих технологических процессах.
Вопрос-ответ

Какие металлы могут образовывать стойкие галогениды?
Различные металлы могут образовывать стойкие галогениды, включая щелочные и щелочноземельные металлы, бериллий и алюминий.
Что такое галогениды и почему они стойкие?
Галогениды - это соединения металлов с галогенами, такими как хлор, бром, йод и фтор. Они являются стойкими, потому что обладают высокой термической и химической стабильностью, что означает, что они не разлагаются или реагируют с другими веществами при обычных условиях.
