Натрий – это химический элемент из группы щелочных металлов, обозначается в периодической системе как Na и имеет атомный номер 11. Он является металлом с серебристо-белым цветом и мягкой консистенцией. Натрий обладает рядом уникальных свойств и широко применяется в различных областях науки и промышленности.
У натрия много отличительных свойств. Одним из них является его высокая реактивность. Натрий может взаимодействовать с кислородом, водой, галогенами и другими веществами, образуя соединения, такие как оксиды, гидроксиды и хлориды. Эта реактивность позволяет использовать натрий в различных химических процессах и применениях.
Важное применение натрия находит в производстве металлургических сплавов. Натрий используется для создания алюминиевых сплавов, которые обладают высокой прочностью и коррозионной стойкостью. Кроме того, натрий также используется в электротехнической промышленности, где он служит источником электролита в различных батареях.
Важно отметить, что натрий также является необходимым минералом для нашего организма. Он регулирует уровень жидкости в клетках, участвует в передаче нервных импульсов и контролирует работу мышц. Недостаток натрия может привести к нежелательным последствиям, таким как дефицит энергии и снижение когнитивных функций.
В заключение, натрий – это металл-неметалл-переходный элемент с уникальными свойствами и широким спектром применения. Он играет значительную роль в промышленности и важен для нашего здоровья. Понимание реакций и свойств натрия позволяет нам лучше использовать его потенциал в нашей повседневной жизни и в научных исследованиях.
Металл-неметалл-переходный элемент натрий:
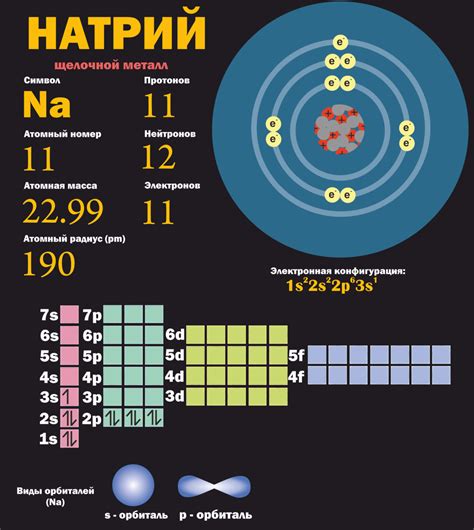
Натрий является химическим элементом, который относится к металл-неметалл-переходным элементам. Он обладает атомным номером 11 и химическим символом Na. Натрий имеет серебристо-белый цвет и является мягким металлом.
У натрия есть несколько характеристических свойств. Он имеет низкую плотность и плавится при относительно низкой температуре, равной 97,79 градусам Цельсия. Натрий хорошо растворяется в воде и образует щелочные растворы.
Переходный элемент натрий имеет множество применений в промышленности и повседневной жизни. Он широко используется в производстве стекла, щелочных батарей, моющих средств и пищевых добавок. Натрий также играет важную роль в биологии и является необходимым компонентом в организме человека для регулирования обмена веществ и работы нервной системы.
Из-за химической реактивности натрия, он образует различные соединения с другими элементами. Натрий может реагировать с водой, выделяя водород, и с кислородом, формируя оксид натрия. Он также может образовывать соли с кислотами и некоторыми другими элементами.
Свойства, применение, реакции

Свойства
Натрий — легкий химический элемент периодической системы с атомным номером 11 и символом Na. Он имеет серебристо-белый цвет и мягкую консистенцию. При комнатной температуре натрий является мягким металлом, который легко режется ножницами. Натрий обладает низкой плотностью и высокой электропроводностью.
Одним из важных свойств натрия является его способность реагировать с водой. При контакте с водой натрий искрится и выделяет водородный газ. Эта реакция яркая и быстрая и может быть опасной без соответствующих мер предосторожности.
Применение
Натрий имеет широкое применение в различных областях. Он используется в производстве стальной прокатки и в других металлургических процессах. Натрий также используется для получения чистого кислорода и вещества, используемых в фармацевтической и пищевой промышленности.
В химической промышленности натрий используется как реагент и катализатор при синтезе органических соединений. Он также используется в производстве стекла и щелочей.
В медицине натрий используется в виде растворов для инфузий и промывания ран. Он также применяется для регулирования жидкостного баланса в организме.
Реакции
Натрий обладает высокой реакционной способностью. Воздействие натрия на хлор приводит к образованию хлорида натрия, на кислород - к образованию оксида натрия, а с верхними неметаллами он реагирует при нагревании, образуя соответствующие соли.
Натрий также является хорошим окислителем. Он может вступать в реакцию с различными веществами, окисляя их и сам восстанавливаясь. Например, он окисляет воду, образуя гидроксид натрия и выделяя водородный газ.
В реакции с кислородом натрий образует оксид натрия, который с водой образует щелочной раствор. Натрий также реагирует с аммиаком, образуя аммиакат натрия. Эти реакции широко используются в лабораторных условиях и в промышленности.
Химические свойства натрия:

Натрий (Na) – химический элемент периодической системы, относящийся к группе щелочных металлов. Он имеет атомный номер 11 и атомную массу около 23. Натрий является мягким и реакционным металлом. В чистом виде он имеет серебристо-белый цвет и мягкую консистенцию.
Натрий реагирует с водой, выделяя водород и образуя гидроксид натрия (NaOH). Реакция натрия с водой является сильно экзотермической, то есть сопровождается выделением большого количества тепла. В результате этой реакции образуется щелочная среда. Гидроксид натрия широко применяется в промышленности, например, для производства стекла.
Натрий также реагирует с кислородом из воздуха, образуя оксид натрия (Na2O). Эта реакция происходит при высокой температуре. Оксид натрия является основным компонентом стекла. Он также используется в производстве керамики и мыла.
Натрий образует соединения с другими элементами, такими как хлор (NaCl), кислород (Na2O) и сера (Na2S). Соединение натрия с хлором, хлорид натрия, известно как поваренная соль. Хлорид натрия широко применяется в пищевой промышленности для приправы пищи и консервирования продуктов. Соединение натрия с серой, сульфид натрия, используется в производстве бумаги и кожи, а также в качестве отбеливателя и протравителя.
Физические свойства натрия:

Натрий – мягкий и серебристо-белый металл, который легко реагирует с воздухом и влагой. Он имеет плотность при комнатной температуре около 0,97 г/см³. Натрий является очень хорошим проводником тепла и электричества, обладает низкой теплопроводностью. Его электрическое сопротивление очень низкое, что делает его идеальным материалом для производства проводов и кабелей.
Температура плавления натрия составляет около 97,8 °C (207,7 °F), что является относительно низким значением для металла. При достаточно высоких температурах натрий может испаряться, образуя голубоватое пламя и оставляя пылающие следы. Натрий является активным металлом и в реакции с водой выделяется водород.
Реактивность натрия в воздухе приводит к образованию оксидов и нитридов на его поверхности. Натрий может быть легко нарезан ножом и образовывать гладкую поверхность из-за его мягкости. Однако при некоторых условиях, например, в присутствии кислорода и влаги, поверхность натрия может образовать сероватый оксидный слой. Это может привести к потере металлического блеска и стабильности материала.
Применение натрия в промышленности:

Натрий является одним из самых распространенных химических элементов и широко применяется в различных отраслях промышленности.
Одним из основных применений натрия является его использование в производстве щелочей, в том числе таких, как гидроксид натрия (натроновая сода). Натрий имеет высокую активность и способен быстро реагировать с водой, что позволяет получать большие объемы щелочи с высокой концентрацией.
Благодаря уникальным свойствам натрия, его также используют в процессе производства стекла. Натрий придаёт стеклу прозрачность, устойчивость к высоким температурам и химической коррозии. Благодаря этому свойству натрий нашел применение в производстве оконных стекол, посуды, фар и других изделий из стекла.
Натрий также используется в процессе производства алюминия. Он является необходимым компонентом электролита, который используется при получении алюминия методом электролиза. Натрий также участвует в реакции депонирования алюминия на катоде.
Кроме того, натрий используется в процессе производства органических соединений, таких как пластмассы, резины и синтетические волокна. Натрий является важным компонентом при получении различных органических соединений и полимеров, которые находят широкое применение в промышленности и повседневной жизни.
Свойства натрия в химических реакциях:

1. Реакция с водой: Натрий обладает высокой реактивностью при взаимодействии с водой. При контакте с водой натрий превращается в гидроксид натрия и выделяет гидроген. Данная реакция происходит очень быстро и сопровождается выделением тепла. При этом образуется щелочная среда.
2. Реакция с кислородом: Натрий реагирует с кислородом, образуя оксид натрия (Na2O). Данная реакция протекает с выделением большого количества тепла и является очень быстрой. Оксид натрия является важной промышленной сырьевой базой.
3. Реакция с хлором: Натрий реагирует с хлором, образуя хлорид натрия (NaCl). Данный процесс является экзотермическим и сопровождается выделением тепла. Хлорид натрия широко применяется в пищевой промышленности, а также в процессе очистки воды.
4. Реакция с серной кислотой: Натрий образует с серной кислотой соль – сульфат натрия и выделяет сероводород. Данная реакция является химической реакцией нейтрализации. Сульфат натрия используется в процессе производства стекла и щелочей.
5. Реакция с аммиаком: При взаимодействии с аммиаком натрий образует соединение аммиакат натрия. Данное вещество активно применяется в лабораторной практике в качестве реагента и индикатора.
Воздействие натрия на организм:

1. Влияние на гормональную систему: Натрий выполняет важную роль в регуляции гормональной активности. Он участвует в синтезе гормонов и регулирует их выделение. Недостаток натрия в организме может привести к нарушениям в работе эндокринной системы.
2. Регулирование водно-солевого баланса: Натрий играет ключевую роль в поддержании нормального состояния клеток организма и проводимости нервных импульсов. Он участвует в регуляции внутриклеточного и внеклеточного давления, а также в работе почек, контролирующих выведение лишней жидкости.
3. Поддержание кислотно-щелочного баланса: Натрий благодаря своим электролитным свойствам регулирует уровень щелочности крови. Он способен нейтрализовать избыток кислотности и поддерживать оптимальный уровень pH. Недостаток или избыток натрия в организме может привести к нарушениям в кислотно-щелочном балансе и серьезным заболеваниям.
4. Участие в обмене веществ: Натрий активно участвует в основных обменных процессах в организме. Он необходим для синтеза белков, жиров и углеводов, а также для энергетических реакций. Натрий также способствует эффективному усвоению других питательных веществ.
5. Регуляция кровяного давления: Натрий, совместно с калием, играет важнейшую роль в регуляции кровяного давления. Он способствует сокращению гладкой мускулатуры сосудов и поддержанию оптимального давления.
6. Сохранение здоровья костей: Натрий необходим для образования и синтеза костной ткани. Он помогает поддерживать оптимальную плотность костей и предотвращает развитие остеопороза.
Биологическая роль натрия:

Натрий – необходимый макроэлемент для организма человека и других животных. Он выполняет важные функции в биологических системах, включая поддержание водно-электролитного баланса организма.
Натрий является основным элементом электролитов, регулирующих концентрацию и транспорт ионов с помощью клеточных мембран. Он играет ключевую роль в поддержании равновесия между внутриклеточной и внеклеточной жидкостью, а также участвует в передаче нервных импульсов и сокращении мышц.
Благодаря своей роли в водно-электролитном балансе, натрий также помогает поддерживать нормальное кровяное давление. Он участвует в регуляции объема циркулирующей крови и контролирует сократимость сосудов.
Обычно натрий получается из пищи, в которой его содержится в виде ионов Na+. Важным источником натрия является поваренная соль, однако избыточное потребление соли может повысить риск развития гипертонии и других сердечно-сосудистых заболеваний.
Натрий также играет роль в регуляции кислотно-щелочного баланса в организме и участвует в метаболических процессах, таких как синтез глюкозы и метаболизм углеводов.
Важность натрия для жизни на планете:
Натрий является одним из самых важных элементов для поддержания жизни на планете Земля. Он играет особую роль в организме человека, а также многих других организмов, и его присутствие необходимо для нормального функционирования биологических систем.
В организме натрий выполняет ряд важных функций. Он участвует в регуляции баланса воды и электролитов, что позволяет поддерживать оптимальное давление крови и обеспечить работу клеток и органов. Кроме того, натрий необходим для передачи нервных импульсов и сокращения мышц, что обеспечивает нормальную работу нервной и мышечной системы.
Благодаря наличию натрия в почве и воде, растения могут поглощать его и использовать для своего роста и развития. Это особенно важно для зерновых культур, таких как пшеница и рис, которые являются основными источниками питания для многих людей.
Кроме того, натрий имеет широкое применение в различных отраслях промышленности. Он используется в производстве стекла, щелочей, моющих средств, а также в производстве химических реагентов. Благодаря своим свойствам, натрий находит применение также в пищевой промышленности, где он используется в качестве консерванта, регулятора кислотности и добавки для улучшения вкуса и текстуры продуктов.
Таким образом, натрий играет критическую роль в жизнеобеспечении на планете. Он не только важен для поддержания здоровья человека и других организмов, но и имеет широкое применение в различных отраслях промышленности. Без наличия натрия, жизнь на Земле была бы невозможной.
Вопрос-ответ

Какие свойства имеет натрий?
Натрий - это металл-неметалл-переходный элемент, обладающий мягкой и серебристо-белой металлической структурой. Он очень реактивный и реагирует с водой, воздухом и многими другими веществами. Натрий имеет низкую плотность и точку плавления, а также высокую теплопроводность и электропроводность.
Какие применения имеет натрий?
Натрий широко применяется в различных областях. Он используется в производстве стекла и щелочных металлов, а также в производстве органических и неорганических соединений. Большое количество натрия используется в пищевой промышленности, как добавка в продукты питания. Он также используется в производстве батарей и солей для воды. В медицине натрий используется в виде растворов для инфузий и прочих лекарственных препаратов.
Какие реакции может претерпеть натрий?
Натрий может реагировать с водой, выделяя горючий газ и образуя щелочную среду. Он также может реагировать с кислородом воздуха, образуя оксид натрия. Натрий может реагировать с хлором, формируя хлорид натрия, с серой, образуя сульфид натрия, и с многими другими веществами.
Каковы особенности реакции натрия с водой?
Когда натрий реагирует с водой, он выделяет газ, называемый водородом, и образует щелочную среду. Во время реакции может возникнуть вспышка или пламя, так как водород горючий газ. Реакция натрия с водой является очень быстрой и яркой.
Почему натрий реагирует с водой и воздухом?
Натрий реагирует с водой и воздухом из-за своей химической активности. Внешний электрон натрия легко потеряется, что позволяет ему образовывать ионы положительного заряда. В результате этой реактивности натрий реагирует с водой, образуя гидроксид натрия, и с кислородом воздуха, образуя оксид натрия.
