Электролиз раствора – один из наиболее распространенных способов получения металла. Однако, не все виды металлов могут быть добыты таким образом. В частности, некоторые металлы не могут быть получены при помощи электролиза раствора. Почему это происходит и какие факты связаны с этим явлением?
Одной из причин, по которой металл не может быть добыт при электролизе раствора, является его структура. Некоторые металлы имеют кристаллическую решетку, которая обусловливает их особые свойства. При попытке провести электролиз такого металла, образуется неоднородная решетка, что препятствует эффективному добыче. Таким образом, структурные особенности металла могут оказаться преградой при электролизе раствора.
Однако, есть и другие факторы, которые могут препятствовать добыче металла при электролизе. Например, наличие примесей в растворе может стать проблемой при проведении электролиза. Некоторые примеси могут изменить физические свойства раствора, что в свою очередь повлияет на эффективность процесса электролиза и, возможно, даже сделает его невозможным.
Важно отметить, что отсутствие возможности добыть металл при электролизе раствора не делает его недоступным для производства. Существуют и другие способы получения металла, такие как термическая обработка или химический способ. Каждый вид металла имеет свои особенности, которые требуют индивидуального подхода к процессу добычи.
В заключение, не все металлы могут быть добыты при электролизе раствора из-за различных факторов, таких как структура металла или наличие примесей в растворе. Однако, это не означает, что эти металлы не могут быть получены вообще. Для каждого металла существуют свои уникальные методы добычи, которые могут быть основаны на термической обработке или химическом способе. Понимание этих фактов позволяет нам более полно раскрыть потенциал металлов и использовать их в различных отраслях промышленности и технологий.
Принцип электролиза растворов

Электролиз растворов основан на применении электрического тока для превращения растворенных веществ в ионы, которые затем могут осаждаться на электродах. Однако, при электролизе растворов металлы не добываются, а скорее просто перераспределяются в виде ионов между положительно заряженным анодом и отрицательно заряженным катодом.
Процесс электролиза начинается с подключения источника постоянного тока к раствору, создавая тем самым разность потенциалов между анодом и катодом. Это приводит к тому, что положительно заряженные ионы из раствора перемещаются к катоду, в то время как отрицательно заряженные ионы движутся к аноду.
У ионов, достигших катода или анода, происходят реакции: положительно заряженные ионы получают электроны и становятся нейтральными атомами или молекулами, которые могут осаждаться на электроде, в то время как отрицательно заряженные ионы отдают свои лишние электроны электроду и остаются в растворе.
Понятие электролиза
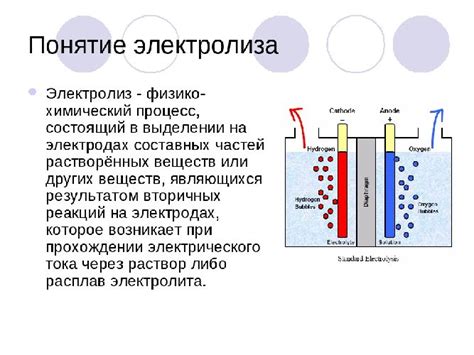
Электролиз – это процесс, в ходе которого разложение вещества происходит под действием электрического тока. Он основан на принципе электродных реакций, где электрический ток приводит к переносу заряда через электролит.
В процессе электролиза приложенная электрическая сила тока вызывает движение положительных и отрицательных ионов, что приводит к разделению вещества на ионы и последующим реакциям на электродах.
Электролиз может происходить в растворах электролитов или плавящихся смесях, когда вещество находится в расплавленном состоянии. Растворы могут содержать различные вещества, такие как соли, кислоты или щелочи.
Электролиз может использоваться для различных целей, таких как получение металлов, очистка растворов от примесей, структурные изменения вещества и другие химические реакции. Он также играет важную роль в промышленности, например, в производстве алюминия, хлора и натрия.
Основными элементами электролиза являются анод и катод, которые послужат местом, где происходят электродные реакции. Анод – это положительный электрод, к которому приходят отрицательно заряженные ионы. Катод – это отрицательный электрод, к которому приходят положительно заряженные ионы. В процессе электролиза происходят окислительно-восстановительные реакции на электродах.
Процесс электролиза в растворе
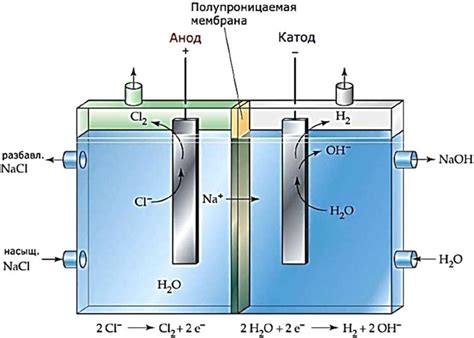
Электролиз в растворе является процессом, при котором, под влиянием электрического тока, происходит разложение раствора на ионы и осуществляется химическая реакция.
В процессе электролиза в растворе применяются два электрода: катод и анод. Катод – это электрод, на который переносятся положительные ионы (катионы), а анод – это электрод, на который переносятся отрицательные ионы (анионы).
При электролизе в растворе происходит окисление анодной концентрации и восстановление катодной концентрации. Анодная концентрация увеличивается за счет процессов окисления, тогда как катодная концентрация уменьшается в результате процессов восстановления.
Электролиз в растворе могут проводить с использованием постоянного и переменного тока. При постоянном токе электролиз протекает с непрерывным характером и позволяет получить осажденные на электродах вещества в виде металлов или газов. При переменном токе электролиз происходит с периодическим изменением тока и применяется для получения других продуктов реакции.
Процесс электролиза в растворе имеет широкое применение в различных отраслях промышленности и научных исследованиях. Он используется для получения чистых металлов, водорода и кислорода, осаждения металлических покрытий, очистки воды и других важных процессов.
Почему металл не добывается при электролизе раствора?

Электролиз раствора является процессом, при котором применяется электрический ток для разложения раствора на составляющие его части. Однако, при этом процессе металл не всегда добывается.
Главной причиной отсутствия добычи металла при электролизе раствора может быть недостаток ионов металла в растворе. Для того чтобы металл мог быть добыт, в растворе должен содержаться достаточное количество ионов металла, которые будут разлагаться под воздействием электрического тока.
Также, для успешной добычи металла при электролизе раствора необходимо подобрать правильные условия, такие как подходящая температура и концентрация раствора, а также правильный выбор анода и катода. Неправильный выбор параметров или материалов может привести к недостаточной реакции между ионами металла и электродами, что в итоге не позволит добыть металл.
Кроме того, электролиз раствора может быть неэффективным при наличии примесей или полимеров в растворе. Примеси и полимеры могут создавать помехи и перекрывать возможность взаимодействия ионов металла с электродами, что делает добычу металла невозможной.
Таким образом, для успешной добычи металла при электролизе раствора необходимо обеспечить наличие достаточного количества ионов металла в растворе, выбрать правильные условия и материалы, а также исключить наличие примесей и полимеров, которые мешают электролизу.
Электролиз ионосодержащих растворов
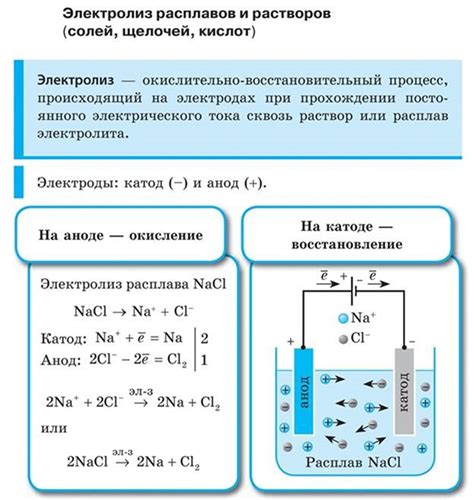
Электролиз является методом получения металлов путем применения электрического тока к растворам, в которых присутствуют ионы металла. Ионосодержащий раствор, подвергаемый электролизу, разделяется на катодную и анодную зоны. Катод – это отрицательный электрод, на котором происходит осаждение металлов, а анод – положительный электрод, где происходят окислительные реакции.
В процессе электролиза ионосодержащих растворов возникает процесс электролитической диссоциации, в результате чего металлические ионы переносятся к электродам и нейтрализуются. На катоде происходит восстановление металлических ионов, что приводит к образованию отложений металла на поверхности катода.
Электролиз ионосодержащих растворов позволяет получать различные металлы, включая как непроизводимые, так и производимые в промышленных масштабах. Важными факторами, влияющими на процесс электролиза, являются концентрация металлического иона в растворе, плотность электрического тока, длительность процесса и выбор материала электродов.
Однако не все металлы могут быть получены при электролизе ионосодержащих растворов. Некоторые металлы обладают высокой степенью реакционной активности и не могут быть извлечены из растворов электролизом. При электролизе некоторых растворов происходит окисление воды, что приводит к выделению кислорода на аноде, а металлические ионы не осаждается на катоде.
Возможные причины отсутствия металла при электролизе раствора

1. Недостаточное содержание металла в растворе: При электролизе раствора металл может отсутствовать из-за низкой концентрации его соединения или исчерпания запасов металла в растворе. Для успешного электролиза необходимо, чтобы концентрация металла в растворе была достаточной для электрохимической реакции.
2. Неправильное выбор изначального соединения металла: Возможно, было выбрано неподходящее соединение металла для электролиза. Некоторые соединения металлов не могут быть электрохимически разложены в растворе.
3. Ошибки в проведении электролиза: В случае отсутствия металла при электролизе раствора возможно были допущены ошибки в проведении процедуры. Некорректная установка источника тока, неправильная положительная и отрицательная электроды, неверная регулировка тока и времени проведения электролиза могут привести к отсутствию металла в результате.
4. Проблемы с электродами: Отсутствие металла может быть связано с проблемами, связанными с использованием электродов. Электроды могут быть загрязнены или несоответствовать требованиям процесса электролиза, что препятствует разложению металла в растворе.
5. Ошибки в расчетах и физических параметрах: Отсутствие металла при электролизе может быть результатом ошибочных расчетов или неправильных заданных физических параметров в процессе. Неверная температура, концентрация, pH или другие параметры влияют на эффективность электролиза и могут вызвать отсутствие металла в результате.
Вопрос-ответ

Как происходит электролиз раствора?
Электролиз раствора – это процесс, при котором происходит разложение раствора на ионы под воздействием электрического тока.
Почему металл не добывается при электролизе раствора?
Металл не добывается при электролизе раствора, потому что процесс электролиза направлен на разложение раствора на его составные ионы, а не на получение металла.
Какие важные факты связаны с процессом электролиза раствора?
Важные факты связанные с электролизом раствора: электрический ток вызывает движение ионов в растворе, положительные ионы движутся к катоду, отрицательные ионы к аноду, в результате разложения ионов на электродах образуются вещества, а металлы не добываются.
