Одна из самых захватывающих и загадочных тайн химических наук заключается в возможности получения металлов путем электролиза водного раствора их солей. Но что делать, когда даже при соблюдении всех необходимых условий и применении современных технологий, некоторые металлы так и остаются неполучаемыми?
Одним из таких металлов является загадочный и прекрасный элемент – магний. Ведь всем известно, что магний широко присутствует в природе, и его соединения используются в различных сферах человеческой деятельности. Но, как ни странно, электролиз водного раствора соли магния в большинстве случаев не приводит к получению искомого металла. Чем обусловлен этот феномен и существует ли возможность преодолеть эту преграду?
Исследователи уже давно занимаются изучением этой тайны и пытаются найти объяснение этому явлению. Одна из самых популярных теорий связывает неполучение металла с особенностями взаимодействия между атомами металла и водой в процессе электролиза. При этом возможны различные сценарии этого взаимодействия, которые не позволяют атомам металла войти в состав электролита и образовать желаемую металлическую массу. Однако, пока что истинная причина остается загадкой.
Возможно, ответ на этот вопрос лежит в глубинах квантовой физики и требует дальнейших исследований и открытий.
Неизвестность тайны металла, неполучаемого при электролизе водного раствора его соли, только усиливает интерес к этой проблеме и стимулирует исследователей продолжать поиски и эксперименты. Возможно, в будущем будут найдены новые способы получения таких металлов, которые до сих пор остаются неприступными. А пока что останется лишь гадать, какие еще загадочные свойства и возможности эта чудесная промышленность сможет нам раскрыть в ближайшем будущем.
Причина неполучения металла при электролизе

Одной из причин, по которой металл не получается при электролизе водного раствора его соли, может быть недостаточная проводимость раствора. Проводимость раствора зависит от его концентрации и при высокой разведенности раствора эффективность электролиза может быть низкой.
Другой причиной может быть неправильный выбор материала электрода. При электролизе важно выбрать материал, который может быть окислен или восстановлен на нужную степень и не растворяется в растворе электролита. Неправильный выбор материала может привести к его разрушению или отложению на электроде, что препятствует получению металла.
Дополнительно, неправильная работа электролизной ячейки может привести к неполучению металла. Неконтролируемое протекание электрического тока или неправильная регулировка параметров электролиза может привести к неблагоприятным условиям для получения металла и его накоплению на электродах.
Наконец, неправильный выбор электролита может быть причиной неполучения металла. При выборе электролита необходимо учитывать его способность предоставить достаточное количество ионов металла для электролиза. Неправильный выбор электролита может привести к снижению эффективности электролиза и неполучению металла в желаемом количестве.
Окисление ионов металла

Окисление ионов металла является одной из важных реакций, происходящих при электролизе водного раствора его соли. Эта реакция происходит на аноде, где ионы металла теряют электроны и переходят в состояние более высокой окислительной степени.
В ходе окисления, происходит образование ионов металла более высокой валентности. Например, ионы железа Fe^2+ восстанавливаются до ионов Fe^3+. Также, металл может образовывать несколько различных ионов, имеющих разную окислительную степень. Например, у железа существуют ионы Fe^2+ и Fe^3+.
Окисление ионов металла является невозможным без проведения соответствующей реакции на катоде. Там, электроны, выделяющиеся при окислении ионов металла на аноде, реагируют с другими веществами, присутствующими в растворе, и возвращаются на анод в виде ионов. Таким образом, окисление и восстановление ионов металла происходят одновременно и являются взаимно связанными процессами.
Влияние электролита на электролиз
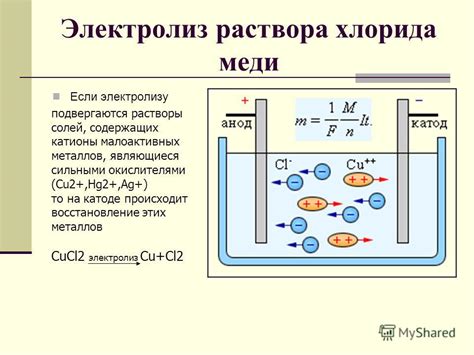
Электролит – вещество, которое при растворении в воде образует ионы и обладает проводимостью электрического тока. При электролизе различных электролитов происходят разные химические реакции, которые могут влиять на процесс выделения металла на электроде.
Одним из важных факторов, влияющих на электролиз, является концентрация электролита в растворе. При повышении концентрации электролита реакция электролиза может ускоряться. Повышение концентрации электролита приводит к большему количеству ионов, доступных для реагирования на электродах, что способствует более интенсивному процессу электролиза.
Влияние электролита на электролиз также может проявляться в изменении напряжения, необходимого для проведения процесса. Некоторые электролиты могут снижать или повышать напряжение необходимое для электролиза. Например, добавление специальных добавок к электролиту может снизить потенциал электролиза, ускорив процесс. Отсутствие или недостаток некоторых ионов в электролите может замедлить электролиз или вовсе сделать его невозможным.
Также влияние электролита на электролиз может проявляться в формировании отложений на электродах. Некоторые электролиты содержат примеси, которые могут образовывать осадки на электродах. Это может привести к изменению эффективности процесса электролиза и необходимости частой чистки электродов.
Особенности водного раствора металла
Водный раствор металла является сложной системой, которая имеет свои особенности и свойства. Этот раствор состоит из металлических ионов, которые растворяются в воде и образуют ионные соединения. Каждый металл имеет свои характеристики и взаимодействует с водой по-своему.
Вода, как растворитель, является полярной молекулой, что обуславливает особенности взаимодействия с металлами. Большинство металлов растворяется в воде при образовании ионов, но есть и такие металлы, которые плохо растворяются или вовсе не растворяются.
Одной из особенностей водного раствора металла является его электропроводность. При растворении металла в воде образуются ионы, которые могут проводить электрический ток. Это свойство применяется в электролизе водного раствора металла с целью получения его неполучаемой металлической формы.
Кроме того, водный раствор металла может обладать различной степенью кислотности или щелочности в зависимости от свойств металла. Некоторые металлы при растворении в воде образуют кислотные растворы, другие - щелочные растворы, а третьи могут быть нейтральными.
Выводя все это в таблицу, можно получить наглядное представление о различных свойствах водного раствора металла, таких как электропроводность, кислотность или щелочность. Эти особенности могут быть использованы при исследовании и определении состава водного раствора металла.
Известные способы преодоления проблемы

На протяжении многих лет ученые и инженеры искали способы решить проблему, связанную с неполучаемостью металла при электролизе водного раствора его соли. Исследования привели к разработке нескольких методов, которые позволяют обойти данное ограничение.
Один из известных способов заключается в применении ультразвукового воздействия на раствор металлической соли. Ультразвуковые волны способствуют разрушению оксидной пленки на электроде, что позволяет осуществить электролиз и получить металл. Этот метод позволяет преодолеть препятствие, связанное с образованием оксидов металла.
Еще одним способом является использование специальных добавок в раствор металлической соли. Эти добавки, называемые ингибиторами, предотвращают или замедляют образование оксидной пленки на электроде, позволяя электролизировать раствор без проблем. Такой метод может быть особенно полезен при работе с растворами, содержащими трудноэлектролизуемые металлы.
Кроме того, был разработан метод использования высокочастотного электромагнитного поля для преодоления проблемы с неполучаемым металлом. Это поле создает особый эффект на поверхности электрода, который помогает разрушить оксидную пленку и обеспечить электролиз раствора. Данный способ также может быть применим для обработки трудноэлектролизуемых металлических солей.
Известные способы преодоления проблемы неполучаемости металла при электролизе водного раствора его соли не только помогают достичь желаемых результатов, но и открывают дальнейшие возможности для исследования и использования металлургических процессов в различных областях науки и промышленности.
Вопрос-ответ

Почему нельзя получить металл при электролизе водного раствора его соли?
Процесс электролиза водного раствора металлической соли связан с тем, что ионы металла при подключении электрического тока к раствору переходят на электроды, где происходят химические реакции, формирующие металл. Однако в некоторых случаях металл не образуется, так как происходит параллельная реакция, при которой ионы металла реагируют с водой, образуя газы или осадок. В результате этого металл не осаждается на электроде и его невозможно получить.
Какие вещества могут образовываться в результате параллельных реакций при электролизе водного раствора металлической соли?
При электролизе водного раствора металлической соли могут образовываться различные вещества в зависимости от свойств металла и условий проведения электролиза. Например, если растворить медь(II)сульфат в воде и провести электролиз, то на аноде будет образовываться кислород, а на катоде – медь. Однако, если использовать раствор меди(II)хлорида, то на аноде будет образовываться хлор, а на катоде – никакого металла не будет.
Почему нельзя получить металл при электролизе раствора соли другого металла?
При электролизе раствора соли другого металла металл, который мы хотим получить, не образуется на электроде. Это связано с тем, что электрический ток вызывает перемещение ионов металла на электроды, но если ионы другого металла находятся в растворе в большем количестве, чем ионы металла, который мы хотим получить, то именно эти ионы будут осаждаться на электроде, а не ионы нужного нам металла.
