Взаимодействие металла с водным раствором нитрата меди 2 является одной из наиболее изученных тем в области химии. Нитрат меди 2 (Cu(NO3)2) представляет собой солюбильную соль, которая полностью диссоциирует в воде. Его раствор обладает ярко-синим цветом и характерным запахом.
При взаимодействии металлов с водным раствором нитрата меди 2 происходит образование осадка или растворение металла в растворе. В зависимости от электрохимических свойств металла, происходят различные реакции: окислительное, восстановительное или нейтрализационное взаимодействие.
Взаимодействие с металлами является основным методом получения меди из ее солей. Например, при погружении чистого железа в раствор нитрата меди 2 происходит реакция, в результате которой медь осаждается на поверхности железа, а железо растворяется.
Таким образом, взаимодействие металла с водным раствором нитрата меди 2 является важной химической реакцией, имеющей многочисленные применения в промышленности и научных исследованиях.
Роль металла в реакции с водным раствором нитрата меди 2
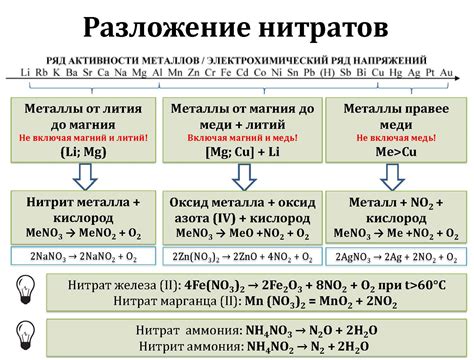
Металл в реакции с водным раствором нитрата меди 2 играет важную роль, обеспечивая проведение химической реакции между двумя веществами. В данном случае металлом выступает цинк.
Цинк выполняет роль редуктора, то есть он участвует в окислительно-восстановительной реакции, в которой происходит передача электронов. Во время реакции цинк окисляется, отдавая два электрона, а ионы меди восстанавливаются, получая эти электроны. Таким образом, цинк действует как вещество, которое передает электроны и участвует в образовании новых химических связей.
Использование металла в реакции с нитратом меди 2 также позволяет наблюдать визуальные изменения. В результате реакции происходит образование отложений меди на поверхности цинка. Медь имеет ярко-красный цвет, поэтому отложения на цинке придают ему красноватый оттенок. Это является еще одним подтверждением того, что металл активно участвует в реакции.
Таким образом, металл играет важную и многогранную роль в реакции с водным раствором нитрата меди 2. Он выполняет функцию редуктора, обеспечивая перенос электронов и образование новых химических связей. Кроме того, металл оставляет видимые отложения меди на своей поверхности, что подтверждает его активную участие в реакции.
Электрохимический процесс взаимодействия
Взаимодействие металла с водным раствором нитрата меди 2 (Cu(NO3)2) является электрохимическим процессом, который происходит в результате переноса электронов между металлом (анодом) и ионами меди (катодом).
В начальный момент взаимодействия металлическая поверхность металла вступает в контакт с раствором нитрата меди 2. Под воздействием раствора на поверхности металла происходит окисление его атомов, при котором они теряют электроны и превращаются в положительно заряженные ионы металла. В данном случае, медь (Cu) из атомного состояния окисляется до катиона Cu2+.
Одновременно с окислением металла происходит восстановление ионов меди в растворе нитрата меди 2. Восстановление происходит за счет того, что свободные электроны отдаваемые металлом, принимаются ионами меди. В результате происходит образование металлической нити на поверхности металла, которая постепенно становится видимой.
Ореол окисления и восстановления, возникающий вокруг металлической нити, продолжает расширяться до тех пор, пока не будет достигнуто равновесие между скоростью окисления и восстановления. В результате этого процесса на поверхности металла образуется покрытие, состоящее из проштампованных частиц меди, которые имеют намного меньший размер по сравнению с изначальной металлической нитью.
Окислительно-восстановительные свойства металла

Металл – это химический элемент, обладающий определенными электрохимическими свойствами. Также металлы могут проявлять свои окислительно-восстановительные свойства, то есть способность переходить из одного окислительного состояния в другое.
В окружающей нас среде многие металлы подвергаются окислению под воздействием кислорода. При этом они могут терять электроны и переходить в положительно заряженные ионы. Это процесс называется окислением. Однако металлы также могут проявлять свои восстановительные свойства, способность принимать электроны и переходить из положительного окислительного состояния в нейтральное или отрицательное восстановительное состояние.
Эти окислительно-восстановительные свойства металлов могут быть использованы в различных химических реакциях. Например, металл может быть использован как катализатор при окислительных реакциях. Это связано с его способностью снижать энергию активации реакции, ускорять скорость химической реакции и снижать необходимую температуру для ее протекания.
Окислительные и восстановительные свойства металла имеют важное значение не только в химии, но и в других науках и промышленности. Например, в электрохимических процессах металлы могут играть роль анода (окислитель) или катода (восстановитель). Их выбор и правильное использование позволяют осуществлять электролиз, гальваническое осаждение и другие процессы, применяемые в производстве и научных исследованиях.
Образование осадка при взаимодействии
При взаимодействии металла с водным раствором нитрата меди 2 происходит образование осадка, что является результатом химической реакции между ионами металла и ионами нитрата меди 2.
В начале реакции ионы металла атомарно образуют слой на поверхности металла. Далее, происходит процесс проникновения ионов металла в раствор, с последующим соединением с ионами нитрата меди 2, что приводит к образованию растворимого комплекса.
Однако, при дальнейшем растворении металла и ионов нитрата меди 2, концентрация этого растворимого комплекса становится слишком высокой и происходит выпадение осадка.
Образование осадка при взаимодействии металла с водным раствором нитрата меди 2 является результатом сложной химической реакции, где ионы металла и ионы нитрата меди 2 образуют растворимый комплекс, который далее выпадает в виде осадка из-за высокой концентрации. Это явление имеет практическое применение в различных областях химии и технологии.
Влияние концентрации и температуры раствора на процесс

Взаимодействие металла с водным раствором нитрата меди 2 зависит от концентрации и температуры раствора. Концентрация раствора имеет существенное влияние на скорость реакции и образование осадка.
При низкой концентрации раствора, взаимодействие металла с нитратом меди 2 происходит медленнее и образование осадка может быть незначительным. Однако, с увеличением концентрации раствора, скорость реакции увеличивается и формируется большее количество осадка.
Также, температура раствора оказывает влияние на процесс взаимодействия. При повышенной температуре реакция протекает быстрее, а осадок образуется в большем количестве. Это объясняется тем, что повышение температуры приводит к увеличению энергии молекул, ускоряя их движение и столкновения.
Однако, слишком высокая температура может привести к нежелательным побочным эффектам, таким как испарение раствора или изменение структуры осадка. Поэтому, важно выбирать оптимальную температуру для проведения реакции в зависимости от целей и требуемого результата.
Вопрос-ответ

Что происходит при взаимодействии металла с водным раствором нитрата меди 2?
При взаимодействии металла с водным раствором нитрата меди 2 происходит реакция окисления-восстановления, в результате которой медь переходит в ионное состояние, а металл вступает в реакцию с нитратом меди 2, что может приводить к образованию осадков или изменению цвета раствора.
Какие металлы могут взаимодействовать с водным раствором нитрата меди 2?
С водным раствором нитрата меди 2 могут взаимодействовать различные металлы, такие как цинк, железо, алюминий и др. Однако, не все металлы будут проявлять одинаковую реакцию. Например, цинк будет вступать в реакцию с нитратом меди 2, образуя осадок из медного металла, алюминий может привести к изменению цвета раствора и т.д.
