Оксиды являются одним из наиболее распространенных классов неорганических соединений. Они состоят из атомов кислорода и других химических элементов и обладают широким спектром свойств и приложений. Особый интерес представляют оксиды, в которых атомы кислорода связаны с валентными атомами металла, например оксид М2О3.
Оксид М2О3 представляет собой соединение, в котором атомы кислорода связаны с двумя атомами металла. В таких соединениях валентные атомы металла могут образовывать различные типы связей с атомами кислорода, что определяет их химические и физические свойства. Кроме того, оксид М2О3 может обладать различными фазовыми состояниями и кристаллическими структурами, что также влияет на его свойства.
Один из ключевых факторов, определяющих свойства оксида М2О3, является валентность атомов металла. Валентность указывает на количество электронов, которое атом металла может передавать или принимать при образовании связей. Валентные атомы металла могут иметь различные валентности, что влияет на степень окисления кислорода и тип связей, образующихся с атомами кислорода в оксиде М2О3.
Таким образом, особенности образования оксида М2О3 валентными атомами металла включают различную степень окисления кислорода, разнообразие типов связей и различные фазовые состояния и кристаллические структуры. Все эти факторы влияют на химические и физические свойства оксида М2О3 и определяют его приложения в различных областях науки и промышленности.
Свойства металлического оксида

Металлический оксид – это соединение металла и кислорода. Оксиды металла обладают рядом свойств, которые определяют их специфическую природу и применение в различных областях науки и промышленности.
Во-первых, металлические оксиды обладают высокой теплопроводностью и электропроводностью. Благодаря этим свойствам они широко используются в производстве электроники и электротехники. Оксиды металла составляют основу для создания различных полупроводников, суперпроводников и других материалов.
Во-вторых, металлические оксиды являются прочными и твердыми материалами. В зависимости от химического состава и структуры, они могут иметь различные механические свойства – от высокой твердости до прочности. Это позволяет использовать оксиды металла в качестве строительных материалов, например, в производстве керамики и стекла. Кроме того, некоторые оксиды металла обладают свойствами ферромагнетизма, что находит применение в разработке магнитных материалов.
В-третьих, металлические оксиды обладают химической инертностью. Они не реагируют с большинством химических веществ и стойки к окружающей среде. Это делает их устойчивыми к коррозии и делает идеальными материалами для различных агрессивных условий, включая высокие температуры и коррозионные среды. Оксиды металла часто используются в качестве защитных покрытий и материалов для химической промышленности.
В-четвертых, металлические оксиды обладают специфическими оптическими свойствами. Они могут поглощать и отражать свет в зависимости от своей структуры и состава. Это позволяет использовать оксиды металла в производстве оптических приборов, солнечных панелей и других устройств, в которых требуется контроль над пропусканием света.
Принципы образования оксида М2О3

Оксид М2О3 образуется в результате взаимодействия валентных атомов металла М с молекулами кислорода (О2) или воды (H2О). Этот процесс происходит при высоких температурах и в присутствии катализаторов.
Валентные атомы металла обладают недостатком электронов во внешней оболочке и стремятся достичь стабильности путем образования химических связей с атомами кислорода. При этом каждый атом металла М может образовать три связи с атомами кислорода, образуя таким образом структурную формулу М2О3, где М представляет собой символ металла.
Связи между атомами металла и кислорода сильны и ионные. Атомы металла теряют электроны и превращаются в положительно заряженные ионы, а атомы кислорода получают электроны и превращаются в отрицательно заряженные ионы. Таким образом, образуется кристаллическая решетка оксида М2О3, в которой ионы металла и кислорода занимают определенные позиции.
Оксид М2О3 обладает определенными физическими и химическими свойствами, которые определяют его применение в различных сферах. Например, оксид алюминия (Al2O3) используется в качестве катализатора, а оксид железа (Fe2O3) применяется в производстве красок и пигментов.
Особенности взаимодействия валентных атомов металла
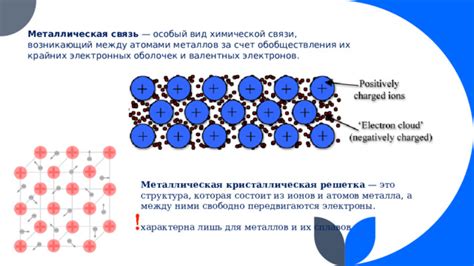
Валентные атомы металла имеют особенности взаимодействия с другими элементами, в частности, с кислородом. Эти особенности являются ключевыми при образовании оксида М2О3.
В процессе взаимодействия валентные атомы металла участвуют в образовании ковалентных или ионных связей с кислородными атомами. Это позволяет металлу вступать в реакцию с кислородом и образовать стабильное соединение — оксид М2О3.
Одной из особенностей взаимодействия валентных атомов металла с кислородом является возможность образования положительных и отрицательных ионов. В случае с оксидом М2О3, валентные атомы металла образуют положительные ионы, а кислородные атомы — отрицательные ионы.
Важным аспектом взаимодействия валентных атомов металла является их электроудерживающая способность. Валентные атомы металла, участвующие в образовании оксида М2О3, обладают недостатком электронов во внешней оболочке, что позволяет им эффективно связываться с кислородными атомами и образовывать стабильные ионы М3+.
Роль оксида М2О3 в различных процессах
Оксиды М2О3 играют важную роль в различных процессах, связанных с использованием металлов. Если рассматривать оксиды М2О3, где М – один из лантанидов или активных металлов, таких как алюминий или железо, то они широко применяются в качестве катализаторов. Эти оксиды обладают высокой активностью и стабильностью, что позволяет применять их в различных химических реакциях.
Оксид М2О3 также используется в процессах, связанных с получением металлов. Например, оксид алюминия (Al2O3), известный как глина или бокситы, является одним из основных источников алюминия. После извлечения алюминия из бокситов происходит его окисление, что приводит к образованию оксида М2О3.
Оксиды М2О3 также имеют широкий спектр других приложений. Например, оксид железа (Fe2O3) используется в производстве различных материалов, включая краски и пигменты, такие как красный оксид железа. Оксиды М2О3 также используются в производстве керамики, стекла и множества электронных устройств.
Вопрос-ответ

Чему равна валентность атомов металла в оксиде М2О3?
Валентность атомов металла в оксиде М2О3 равна +3.
Почему в оксиде М2О3 валентность атомов металла равна +3?
В оксиде М2О3 атомы металла образуют ионы с зарядом +3, так как окислительное число кислорода равно -2, а сумма зарядов в молекуле между металлом и кислородом должна быть равна 0.
Какие металлы могут образовывать оксид М2О3 с валентностью +3?
Многие металлы могут образовывать оксид М2О3 с валентностью +3, например, алюминий (Al2O3), хром (Cr2O3), железо (Fe2O3), галлий (Ga2O3) и другие.
Какие особенности имеет образование оксида М2О3 валентными атомами металла?
Основная особенность образования оксида М2О3 состоит в том, что атомы металла образуют ионы с валентностью +3, а кислород имеет окислительное число -2. Такая комбинация зарядов обеспечивает электронейтральность оксида.
Как влечет образование оксида М2О3 валентными атомами металла к изменению свойств вещества?
Образование оксида М2О3 валентными атомами металла может привести к изменению свойств вещества. Например, многие оксиды М2О3 обладают высокой термической и химической устойчивостью, образуют специфическую кристаллическую структуру и обладают свойствами полупроводников.
