Металлы – одни из самых распространенных и важных материалов в нашей жизни. Они используются во множестве отраслей, начиная от строительства и заканчивая медициной. Но как устроен сам металл и какова его структура?
Металлы являются кристаллической решеткой, в которой атомы соединены между собой. Кристаллическая решетка представляет собой упорядоченную систему атомов, которая образует периодическую структуру. Другими словами, атомы расположены в определенном порядке, образуя регулярную сетку. Кристаллическая решетка дает металлам их механические и электрические свойства, такие как проводимость электричества и теплопроводность.
Металлическая решетка состоит из атомов, которые могут быть однотипными или разными по своим химическим свойствам. В зависимости от типа атомов, металлическая решетка может быть разной структуры. Например, некоторые металлы образуют кубическую решетку, в то время как другие металлы образуют гексагональную или тетрагональную решетку. Каждый металл имеет свою уникальную структуру, которая определяет его свойства и способность к обработке.
Молекула – это структурная единица вещества, состоящая из атомов, связанных между собой химическими связями. Металлы не образуют молекулы, так как атомы в них соединены между собой не химическими, а металлическими связями. Поэтому металлы не являются молекулами, а представляют собой атомарную структуру.
Таким образом, металлы образуют атомарную структуру, где атомы соединены между собой металлическими связями, образуя кристаллическую решетку. Эта структура определяет механические, электрические и химические свойства металлов.
Металлические элементы: состоят ли они из атомов или молекул?
Металлические элементы, такие как железо, алюминий или медь, представляют собой особый класс химических элементов, которые обладают специфическими физическими и химическими свойствами. Однако, по сравнению с неметаллами, металлические элементы обладают различной структурой, поэтому их не всегда можно описать как атомы или молекулы.
Металлы отличаются специфической решеткой, которая состоит из ионов. Атомы металлов теряют или приобретают электроны, образуя ионы с положительным или отрицательным зарядом. Эти ионы образуют кристаллическую решетку, которая дает металлу его типичные свойства, такие как высокая электропроводность, термическая проводимость и гибкость.
Таким образом, металлические элементы могут быть описаны как состоящие из атомов, которые образуют ионы и формируют характерную кристаллическую структуру. Однако, в отличие от молекул, где атомы объединяются через ковалентные связи, металлические элементы объединяются через ионные связи, что придает им их специфические свойства.
Металлы: ключевые характеристики и свойства
Металлы - это класс веществ, обладающих рядом уникальных характеристик и свойств. Характерными особенностями металлов являются высокая электропроводность, теплопроводность и пластичность. Также металлы обладают блеском и отличаются от неметаллов тем, что способны образовывать ионные соединения.
Электропроводность - одна из основных характеристик металлов. Именно благодаря своей способности проводить электрический ток, металлы широко применяются в производстве проводов, контактов и электронных устройств. Кроме того, металлы обладают высокой теплопроводностью, что делает их незаменимыми материалами в производстве котлов, радиаторов и других теплоотдающих устройств.
Пластичность - еще одно свойство металлов, которое делает их уникальными. Металлы способны подвергаться пластической деформации, что означает, что их можно легко изменять форму без разрушения. Благодаря пластичности, металлы используются в множестве отраслей, включая машиностроение, строительство и производство деталей.
Ионные соединения - еще одна ключевая характеристика металлов. Металлы способны образовывать положительно заряженные ионы и образовывать ионные соединения с неметаллам. Это позволяет использовать металлы в производстве солей, кислот и других химических соединений.
Блеск - внешняя характеристика металлов, которая проявляется благодаря специфической структуре их поверхности. Блеск делает металлы привлекательными для использования в ювелирных изделиях и декоративных элементах. Благодаря блеску металлы придают предметам элегантность и привлекательность.
Структура металлов: от микроскопического уровня к макроскопическому
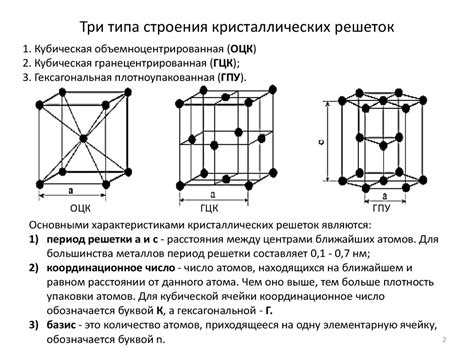
Структура металлов является одной из ключевых характеристик, определяющих их особенности и свойства. Металлы, в отличие от других веществ, обладают особой структурой, которая позволяет им образовывать кристаллическую решетку.
На микроскопическом уровне, металлы представляют собой сеть атомов, которые упорядочены в регулярном трехмерном пространстве. Каждый атом окружен несколькими соседними атомами, что образует кристаллическую решетку. Именно благодаря этой упорядоченной структуре металлы обладают своими уникальными физическими и химическими свойствами.
Макроскопически, металлы имеют специфическую геометрическую форму. В зависимости от типа металла, они могут быть представлены в виде проволоки, пластин, листов, труб или различных изделий. Эта геометрическая структура несет в себе не только функциональное значение, но и отражает определенные механические и технические свойства материала.
Структура металлов напрямую влияет на их электропроводность, магнитные и тепловые свойства. Более того, структура может меняться под воздействием различных факторов, таких как температура, давление или электрический ток. Это придает металлам уникальные возможности в различных сферах применения, от инженерии и строительства до электроники и медицины.
Связь в металлах: межатомная или межмолекулярная?

Металлы представляют собой особый класс материалов, обладающих высокой электропроводностью и способностью образовывать характерные кристаллические решетки. Одним из ключевых вопросов, который возникает при изучении металлов, является вопрос о связи между атомами или молекулами в металлическом материале.
Первоначально предполагалось, что металлы состоят из молекул, связанных между собой через слабые взаимодействия. Однако с развитием квантовой механики была предложена альтернативная модель, согласно которой металлический материал состоит из кристаллической решетки, в которой атомы металла занимают узлы и связаны между собой сильными межатомными связями.
Экспериментальные данные подтверждают, что связь в металлах является межатомной, то есть между атомами металла существуют сильные взаимодействия. Это обуславливает высокую пластичность и электропроводность металлов, так как электроны могут свободно перемещаться по кристаллической решетке.
Связь в металлах характеризуется также металлической связью, которая отличается от ионной или ковалентной связи, присущей молекулам. Металлическая связь основана на силовом взаимодействии электронов, находящихся в зоне проводимости, с положительными ядрами атомов металла. Именно эти особенности связи делают металлы хорошими проводниками тепла и электричества.
Таким образом, можно сделать вывод, что связь в металлах является межатомной. Межатомные связи обеспечивают специфические физические свойства металлических материалов и являются основой для их широкого применения в различных отраслях промышленности и науки.
Кристаллическая решетка: основа структуры металлических материалов
Кристаллическая решетка является основой структуры металлических материалов и определяет их свойства. Размещение атомов или ионов в металле происходит в определенном порядке, образуя упорядоченную структуру.
Кристаллическая решетка металлов обладает рядом характерных свойств, таких как высокая плотность, прочность, упругость и теплопроводность. Эти свойства обусловлены особенностями взаимодействия атомов внутри решетки.
Расположение атомов в кристаллической решетке определяется симметрией решетки и характером связей между атомами. Металлическая связь, которая образуется между атомами металла, связана с обменом электронами и образованием электронного облака, которое окружает положительно заряженные ядра атомов. Это позволяет металлам обладать высокой электропроводностью и теплопроводностью.
Кристаллическая решетка металлов может иметь различные формы, которые соответствуют разным типам упаковки атомов. Наиболее распространенные типы решеток в металлах - кубическая гранецентрированная (ГЦК), кубическая гранецентрированная (ГЦК) и гексагональная ближнепакетная (ГБЦ), каждая из которых имеет свои уникальные особенности.
Кристаллическая решетка металла определяет его кристаллическую структуру и свойства, такие как механическая прочность, пластичность, проводимость и теплоемкость. Понимание структуры решетки является важным для разработки новых и улучшения существующих металлических материалов.
Особенности металлических связей и электронная структура

Металлы обладают характерной структурой, которая обеспечивает уникальные свойства данных материалов. Основой металлической связи является наличие свободных электронов, перемещающихся по всей структуре кристаллической решетки. Эта свободная "область" электронов называется электронным газом или морем электронов.
В металлической связи атомы металла располагаются в кристаллической решетке, при этом электроны между атомами сильно перемещаются, образуя совместные электронные облака. Значительная подвижность электронов делает металлы отличными проводниками тепла и электричества, так как электроны легко передают свою энергию друг другу.
Электроны в металлах могут занимать различные энергетические уровни, образуя так называемую электронную структуру материала. Это объясняет яркую цветность многих металлов, так как электроны находятся в возбужденных состояниях и при взаимодействии с электромагнитным излучением испускают световую энергию определенной частоты.
Металлы обладают также высокой пластичностью и хорошей текучестью. Это связано с деформацией кристаллической решетки и перемещением электронов по всему материалу. Такая структура позволяет металлам выдерживать большие механические нагрузки и поддерживать свою форму даже при деформациях.
Металлы и их отношения к атомам и молекулам: научные теории и подходы

Металлы - это один из основных классов веществ, которые обладают специфическими химическими и физическими свойствами. Для понимания структуры металлических материалов и их отношения к атомам и молекулам было предложено несколько научных теорий и подходов.
Одной из самых распространенных теорий является теория кристаллической решетки. Согласно этой теории, металлы состоят из атомов, которые упорядочены в трехмерной кристаллической решетке. Такая структура обеспечивает металлам их характерные физические свойства, такие как высокая проводимость электричества и тепла.
Существует также теория электронного газа, которая объясняет поведение металлов с помощью понятия свободных электронов. Согласно этой теории, в металлах некоторое количество электронов может свободно перемещаться внутри кристаллической решетки, что обуславливает их высокую проводимость и другие электронные свойства.
Однако, существуют и другие подходы к описанию металлов. Некоторые исследователи предлагают использовать модели, основанные на квантовой механике, чтобы объяснить свойства металлов на уровне отдельных атомов и их взаимодействия. Такие модели помогают объяснить некоторые нетипичные свойства металлов и предсказать их поведение в экстремальных условиях.
Итак, теории и подходы, связанные с атомами и молекулами, играют важную роль в понимании структуры и свойств металлов. Несмотря на существующие различия в подходах, все эти теории исследуют металлы с разных сторон, позволяя нам лучше понять природу этого класса веществ и использовать их свойства в различных областях науки и технологии.
Вопрос-ответ

Могут ли металлы образовывать молекулы?
Да, металлы могут образовывать молекулы. Однако, в отличие от молекул других веществ, молекулы металлов обычно состоят не из двух или более атомов, а из большего числа атомов, объединенных великим числом химических связей.
Почему металлы имеют высокую температуру плавления и кипения?
Металлы имеют высокую температуру плавления и кипения из-за особенностей их атомной структуры. Атомы металлов обладают довольно свободной структурой и сильными химическими связями, что требует большого количества энергии для разрыва связей и перехода в жидкое или газообразное состояние.
Какие свойства металлов связаны с их атомной структурой?
Свойства металлов, такие как хорошая теплопроводность, электропроводность и блеск, связаны с их атомной структурой. Атомы металлов обладают свободными электронами, которые легко передвигаются внутри металлической решетки, обеспечивая эти свойства.
Какие элементы относятся к металлам?
К металлам относятся большинство элементов в периодической системе, такие как железо, алюминий, медь, свинец, золото, серебро и др. Также металлами являются щелочные металлы (натрий, калий, литий), щелочноземельные металлы (магний, кальций, барий) и многие другие.
Какие свойства выделяют металлы среди других веществ?
Металлы выделяются такими свойствами, как хорошая теплопроводность, высокая электропроводность, блеск, деформируемость и т.д. В отличие от неметаллов и полуметаллов, металлы часто образуют катионы в растворах и имеют химические свойства оснований.
