Металлические кислотные оксиды и соединения соляной кислоты представляют собой важный класс химических соединений с широким спектром применений. Они обладают уникальными физическими и химическими свойствами, что делает их полезными в различных отраслях промышленности и науки.
Примером металлического кислотного оксида является оксид серы (VI) или сульфированный оксид. Это соединение образуется в результате соединения металлического ионного кислородного и ионного серного компонентов. Оксид серы (VI) широко используется в производстве кислоты серной, которая является важным ингредиентом для производства удобрений, пластиков и других химических продуктов. Более того, оксид серы (VI) также применяется в качестве катализатора в реакциях окисления и гидрирования многих органических соединений.
Соляная кислота (хлористоводородная кислота) также имеет широкий спектр применений и используется во многих отраслях промышленности. Это одна из сильнейших кислот, которая имеет сильное разъедающее действие на большинство металлов и образует хлориды с многими металлами.
Примером соединения соляной кислоты является хлорид натрия (NaCl).
Хлорид натрия широко используется в пищевой промышленности в качестве консерванта и добавки в продукты питания. Это также важный компонент при производстве стекла, пластмасс, мыла и других химических продуктов. Кроме того, хлорид натрия используется в медицине для поддержания водно-солевого баланса в организме и в качестве ингредиента для приготовления растворов для инъекций и очистки ран.
Примеры металлических кислотных оксидов
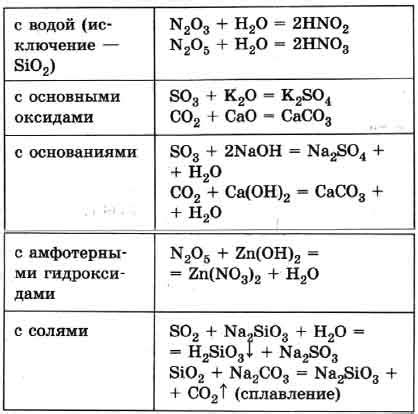
Металлические кислотные оксиды являются соединениями металлов с кислородом, которые характеризуются высокой реактивностью и полезными свойствами. Некоторые из них находят широкое применение в различных отраслях промышленности и научных исследованиях.
Один из наиболее распространенных и известных примеров металлических кислотных оксидов - оксид железа (III) (Fe2O3), также известный как гематит. Он обладает ярким красным цветом и используется в производстве красок, керамики, стекла и магнитных материалов.
Еще одним примером металлического кислотного оксида является оксид алюминия (Al2O3), который известен как корунд. Он используется в производстве абразивов, катализаторов, стекол и керамических изделий.
Оксид меди (II) (CuO) - еще один пример металлического кислотного оксида. Он имеет черный цвет и используется в производстве катализаторов, красителей, пигментов и электроники.
Некоторые другие примеры металлических кислотных оксидов включают оксид магния (MgO), оксид цинка (ZnO), оксид кальция (CaO) и оксид антимона (Sb2O3). Каждый из этих соединений имеет свои уникальные свойства и применения в различных отраслях науки и промышленности.
Оксид алюминия

Оксид алюминия (Al2O3) является одним из наиболее распространенных металлических кислотных оксидов. Этот неорганический соединение образуется при окислении алюминия и имеет белый цвет.
Оксид алюминия широко используется в различных промышленных отраслях. Он является основным компонентом цемента и стекла, а также используется в производстве керамики, эмалей и расписок. Благодаря своей высокой теплостойкости и химической стойкости, оксид алюминия применяется в производстве огнеупорных материалов и литейных форм для металлургии.
Оксид алюминия также используется в качестве абразивного материала. Например, в производстве шлифовальных кругов и абразивной бумаги. С его помощью можно обрабатывать различные поверхности, включая металлические и керамические, достигая высокой точности и качества обработки.
Кроме того, оксид алюминия используется в производстве электронных компонентов, таких как полевые транзисторы и интегральные схемы. Его применение связано с его диэлектрическими свойствами, которые позволяют использовать его в качестве изоляционного материала в электронике.
Оксид меди

Оксид меди – это химическое соединение, образующееся при окислении меди и обладающее формулой CuO. В природе оксид меди можно найти в виде минерала малахит.
Оксид меди является темно-черным кристаллическим веществом с молекулярной массой 79,55 г/моль. Он не растворим в воде, но растворяется в кислотах и щелочах. Оксид меди обладает амфотерными свойствами и может действовать как основание и кислота.
Использование оксида меди в промышленности весьма разнообразно. Он находит применение в производстве керамики, электроники, красок, пигментов и стекла. Оксид меди также используется в качестве катализатора при различных химических реакциях.
Оксид меди обладает хорошей проводимостью электричества и тепла, что позволяет его использовать в электронике для создания проводящих элементов. Кроме того, оксид меди стабилен при высоких температурах, что делает его полезным материалом для изготовления керамических покрытий.
Оксид железа

Оксид железа – это химическое соединение, состоящее из атомов железа и кислорода. В зависимости от соотношения между атомами этих элементов, оксид железа может быть представлен в нескольких формах: FeO, Fe2O3 и Fe3O4.
FeO, также известный как оксид железа(II), является самым простым оксидом железа. Он имеет черный цвет и используется в качестве катализатора и компонента в производстве стали и железного сплава. FeO растворяется в воде с образованием щелочной среды.
Fe2O3, или оксид железа(III), является распространенной формой оксида железа. Он имеет красный цвет и используется в качестве красящего вещества, например, для окрашивания керамики и стекла. Он также является основным компонентом ржавчины и ржавого железа.
Fe3O4, или оксид железа(II,III), является смешанным оксидом железа. Он обладает черным цветом и является магнитным материалом. Fe3O4 используется в производстве магнитов и магнитных материалов.
Все эти формы оксида железа являются кислотными оксидами, что означает, что они растворяются в воде, образуя кислотные растворы. Оксиды железа также являются важными промышленными и химическими соединениями, которые находят широкое применение в различных отраслях промышленности и технологии.
Соединения соляной кислоты

Соляная кислота (хлороводородная кислота) является одним из наиболее распространенных кислотных соединений. Она обладает формулой HCl и в чистом виде представляет собой безцветную жидкость с резким запахом. Соли и оксиды, полученные из соляной кислоты, также широко распространены и имеют различные применения.
Одним из важных соединений соляной кислоты является хлорид натрия (NaCl), который известен как поваренная соль. Он широко используется в пищевой промышленности для соления и придания вкуса различным продуктам. Хлорид натрия также является основным компонентом морской воды.
Кроме того, соляная кислота используется для производства хлорида кальция (CaCl2). Это соединение широко применяется в медицине, а также в промышленности, в основном как сушитель и охлаждающая среда. Хлорид кальция также используется для устранения сосулек и льда на дорогах и тротуарах.
Другим важным соединением соляной кислоты является хлорид железа (FeCl3). Он используется в большом количестве промышленных процессов, включая производство железа и стали, а также в качестве коагулянта для очистки воды.
Все эти соединения соляной кислоты имеют широкое применение в различных отраслях промышленности и жизни человека. Они играют роль в производстве, пищевой промышленности, медицине и других сферах, что делает соляную кислоту важным и неотъемлемым компонентом нашей жизни.
Вопрос-ответ

Какие примеры металлических кислотных оксидов существуют?
Примерами металлических кислотных оксидов являются оксиды металлов, которые могут образовывать кислотные растворы взаимодействуя с водой. Например, оксид алюминия (Al2O3), оксид железа (Fe2O3), оксид меди (CuO) и оксид цинка (ZnO).
Какие соединения соляной кислоты можно привести в качестве примеров?
Соляная кислота (HCl) образует различные соединения, известные как хлориды. Примерами таких соединений являются хлорид натрия (NaCl), хлорид калия (KCl), хлорид кальция (CaCl2) и хлорид железа (FeCl3).
Какие металлы существуют, дающие кислотные оксиды?
Многие металлы способны образовывать кислотные оксиды. Некоторые из них включают алюминий, железо, медь, цинк, марганец, титан и хром.
Что происходит, когда металл с реагирует с водой?
Когда металл взаимодействует с водой, он может образовывать кислотные растворы в результате образования металлического кислотного оксида. При этом образуется соединение соляной кислоты с металлом и выделяется водородный газ.
Какие свойства у металлических кислотных оксидов?
Металлические кислотные оксиды обладают различными свойствами. Некоторые из них являются кислотными и могут растворяться в воде, образуя кислотные растворы. Другие оксиды могут быть основными и образовывать щелочные растворы. Есть также оксиды, которые обладают амфотерными свойствами и могут проявлять как кислотные, так и щелочные свойства.
