Взаимодействие металлов с различными веществами является областью активных исследований в химии. Одной из важных реакций является взаимодействие металлов с водой. В результате этой реакции может образоваться основание, однако не все металлы способны таким образом реагировать. В этой статье рассмотрим, почему некоторые металлы не образуют основание при взаимодействии с водой.
Металлы способны реагировать с водой при условии, что они обладают достаточной электрохимической активностью. Это связано с возможностью отдать электроны из своей внешней оболочки и образовать положительные ионы. Металлы, такие как натрий и калий, обладают высокой электрохимической активностью и реагируют с водой водно-реактивной серией.
Однако, некоторые металлы не образуют основание при взаимодействии с водой из-за их низкой электрохимической активности. Это связано с тем, что у этих металлов слабая способность отдавать электроны. В результате взаимодействия таких металлов с водой образуется оксид металла или его гидроксид, но не основание.
Примером металла, не образующего основание при взаимодействии с водой, является железо. Железо образует оксид железа (III) Fe2O3 и гидроксид железа (III) Fe(OH)3. Однако, они не образуют основания в воде.
Понимание того, почему некоторые металлы не образуют основание при взаимодействии с водой, является важным для изучения химических реакций и позволяет более глубоко понять химические свойства различных веществ.
Металл и вода: причины неполучения основания

Взаимодействие металла с водой может привести к образованию основания - вещества, обладающего щелочными свойствами. Однако иногда это взаимодействие не приводит к непосредственному образованию основания. Почему это происходит?
Один из основных факторов, препятствующих образованию основания при взаимодействии металла с водой, это пассивация металла. Пассивация - процесс образования на поверхности металла защитной пленки, которая предотвращает дальнейшее реактивное взаимодействие с окружающей средой. В результате пассивации металл может не образовывать основание при контакте с водой.
Другой важной причиной неполучения основания может быть низкая активность металла. Если металл обладает низкой активностью, то его взаимодействие с водой происходит медленно и не порождает достаточное количество основания. Активность металла зависит от его реакционной способности и электрохимического потенциала.
Также влиять на образование основания может присутствие других веществ в образующейся реакции. Например, наличие растворенных газов или солей может изменить реакционные условия и привести к образованию других продуктов, вместо основания. Это значит, что условия эксперимента или контакта металла с водой могут значительно влиять на результат реакции и образование или неполучение основания.
Таким образом, причины неполучения основания при взаимодействии металла с водой могут быть связаны с пассивацией металла, его низкой активностью и присутствием других веществ, изменяющих условия реакции. Изучение данных факторов позволяет более глубоко понять причины процессов, происходящих при взаимодействии металла с водой и их влияние на образование основания.
Химические реакции и реакционная способность
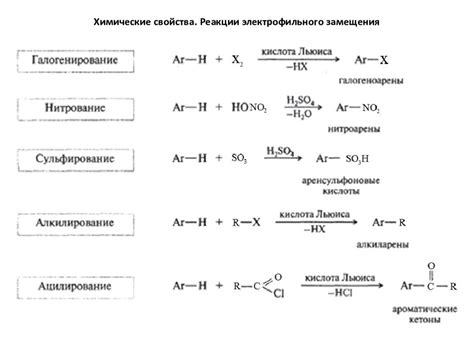
Химические реакции являются основой для понимания и изучения химии. Они представляют собой процессы, в результате которых происходит превращение вещества или образование новых веществ. Химические реакции протекают взаимодействием атомов, ионов или молекул.
Реакционная способность вещества определяется его способностью взаимодействовать с другими веществами и претерпевать химические изменения. Реакционная способность зависит от электронной структуры атомов и молекул, их связей и наличия свободных электронов.
Химические реакции могут быть разделены на различные классы в зависимости от типа взаимодействующих веществ. Например, окислительно-восстановительные реакции происходят при взаимодействии окислителя и восстановителя, что приводит к переходу электронов между веществами.
Реакции с обменом ионами происходят, когда ионы одного вещества обмениваются местами с ионами другого вещества, образуя новые соединения. Это часто наблюдается при взаимодействии солей с растворами.
Необратимые химические реакции имеют место, когда продукты реакции не могут обратно превратиться в исходные вещества. В таких реакциях происходит образование новых связей и образование несвязанных веществ.
Пассивация и защитные слои

Пассивация - это процесс, при котором поверхность металла покрывается защитным слоем, обеспечивающим его стойкость к окружающим средам. Защитные слои могут образовываться на металле естественным путем или быть созданными искусственно.
Естественная пассивация происходит, когда металл взаимодействует с окружающей средой и образует на своей поверхности оксидный слой. Например, алюминий при контакте с воздухом образует прочный и стойкий к коррозии оксид алюминия. Такой слой защищает металл от дальнейшего окисления и разрушения, длительно сохраняя его свойства.
Искусственная пассивация может быть достигнута путем нанесения специальных покрытий на поверхность металла. Например, оцинкование - это процесс нанесения цинкового слоя на поверхность стали. Цинк создает защитную пленку, предотвращающую проникновение влаги и кислорода до стали, и таким образом предотвращает ее коррозию. Также существуют другие методы искусственной пассивации, такие как нанесение оксидных слоев, анодирование, химическое осаждение и т. д.
Защитные слои являются важной составляющей в устойчивости металла к водной среде. Они предотвращают проникновение влаги и кислорода до металлической поверхности, а также защищают от агрессивных химических веществ. Благодаря пассивации и защитным слоям металлы могут длительно сохранять свою прочность, стойкость и эстетический вид, оставаясь устойчивыми к различным факторам окружающей среды.
Электрохимический потенциал металлов и коррозия
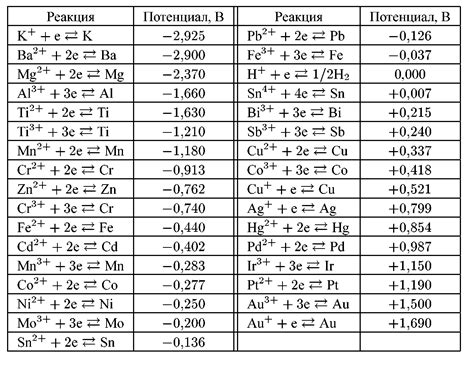
Электрохимический потенциал металлов играет важную роль в протекании коррозионных процессов. Каждый металл имеет свой уникальный потенциал, которым определяется его активность в электрохимической системе. Более активные металлы имеют более высокий положительный потенциал, а менее активные - более низкий или даже отрицательный.
Коррозия происходит, когда два металла с разными потенциалами вступают в контакт с водой. При этом более активный металл будет осаждаться, а менее активный будет растворяться под влиянием электрохимических процессов. В результате такого взаимодействия, слабый металл может быть разрушен и образуются коррозионные отложения на поверхности более активного металла.
Примером такого взаимодействия является коррозия железа в присутствии воды. Железо имеет более низкий потенциал, чем вода, поэтому его активность выше. В результате, под воздействием влаги, железо окисляется и поражается коррозией, а вода оказывается необходимой составляющей для протекания электрохимических реакций.
Для предотвращения коррозии используются различные методы, такие как нанесение защитных покрытий на поверхность металла или использование анодной защиты. Также важно контролировать условия эксплуатации, чтобы минимизировать влияние влаги или других агрессивных сред на металлические конструкции.
Взаимодействие металлов с растворами воды
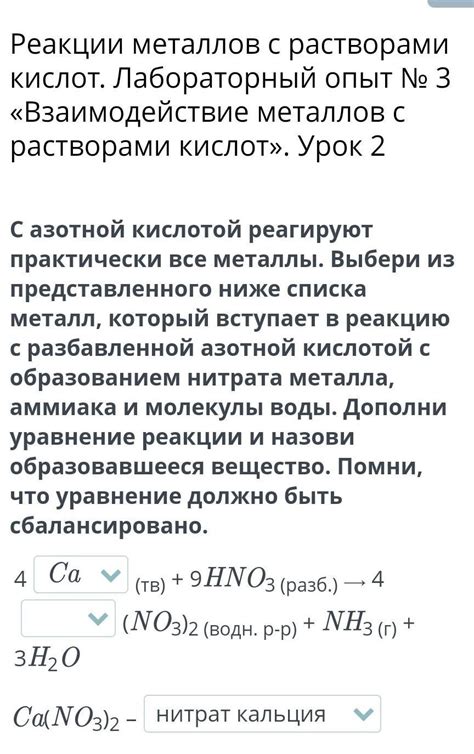
Металлы обладают способностью взаимодействовать с растворами воды, и это взаимодействие может приводить к различным результатам. Некоторые металлы активно реагируют с водой, выделяя газы и образуя гидроксиды, в то время как другие металлы проявляют пассивность и не меняются при контакте с водой. Это связано с химическими и физическими свойствами металлов.
Металлы, которые активно реагируют с водой, обладают высокой химической активностью и относятся к группе щелочных и щелочноземельных металлов. Их взаимодействие с водой сопровождается выделением водорода и образованием щелочных гидроксидов. Например, натрий реагирует с водой с образованием гидроксида натрия и выделением водорода. Эта реакция очень интенсивна и может сопровождаться высвобождением большого количества энергии.
С другой стороны, некоторые металлы не реагируют с водой, такие как золото, серебро и платина. Они обладают низкой активностью и не окисляются при взаимодействии с водой. Такие металлы называются пассивными. Их устойчивость к окислению связана с тем, что они образуют тонкую пленку оксида, которая защищает металл от дальнейшего взаимодействия с водой.
Взаимодействие металлов с растворами воды является важным аспектом в химии и применяется в различных областях, таких как производство водорода, электрохимические процессы и другие технологии. Понимание этого взаимодействия позволяет контролировать реакции и использовать металлы с максимальной эффективностью.
Практическое применение и проблемы взаимодействия

Взаимодействие металла с водой имеет широкое практическое применение в различных областях. Например, в металлургии используются процессы гидрометаллургии, при которых металлы извлекают из руды, используя химические реакции с водой. Также водные растворы служат электролитами в батареях и аккумуляторах, где при прохождении электрического тока происходит окисление и восстановление металла.
Однако при взаимодействии металла с водой могут возникать определенные проблемы. Например, некоторые металлы, такие как железо, могут подвергаться коррозии при контакте с водой. Это происходит из-за электрохимических реакций между металлом и водой, которые приводят к образованию оксидов и гидроксидов металла.
Еще одной проблемой может быть образование осадка при взаимодействии металла с водой. Например, при взаимодействии кальция с водой образуется осадок из вещества нерастворимого в воде - гидроксида кальция. Этот процесс может привести к засорению водопроводных труб и других систем, где используется вода.
Определенные проблемы возникают также при использовании металлических изделий во влажных условиях. Например, металлические предметы, находящиеся под действием влаги, могут подвергаться коррозии и разрушению со временем. Для защиты металла от взаимодействия с водой могут применяться различные методы, включая гальваническое покрытие, применение специальных покрытий, а также использование противокоррозионных материалов.
Таким образом, хотя взаимодействие металла с водой имеет практическое применение в различных областях, оно также может вызывать определенные проблемы, связанные с коррозией и образованием осадка. Поэтому необходимо учитывать эти факторы при разработке и использовании металлических изделий и систем во влажных условиях.
Вопрос-ответ

Почему при взаимодействии металла с водой не образуется основание?
При взаимодействии металла с водой не образуется основание из-за низкой реакционной активности металла, которая не позволяет ему участвовать в гидролизе и образовании основания.
Какие металлы не образуют оснований при контакте с водой?
Металлы, не образующие оснований при контакте с водой, включают в себя алюминий, железо, цинк, свинец и некоторые другие металлы со средней или низкой реакционной активностью.
Возможно ли получение оснований при взаимодействии металлов со специальными веществами вместо воды?
Да, возможно получение оснований при взаимодействии металлов со специальными веществами, которые способствуют гидролизу и образованию основания. Например, при взаимодействии алюминия с раствором щелочи получается основание - гидроксид алюминия Al(OH)₃.
Какой процесс происходит при взаимодействии металла с водой?
При взаимодействии металла с водой происходит окислительно-восстановительная реакция, в результате которой металл окисляется, а вода восстанавливается. Однако, при низкой реакционной активности металла, такой как алюминий или цинк, этот процесс протекает медленно и не приводит к образованию основания.
Есть ли другие способы получения оснований, помимо взаимодействия металла с водой?
Да, помимо взаимодействия металла с водой, основания можно получить путем реакции некоторых неорганических соединений, например, оксидов металлов или солей кислот, с водой. Также основания можно получить с помощью некоторых органических соединений, таких как аммиак или аминокислоты.
