Металл-кислотная реакция нейтрализации - это химическая реакция между металлом и кислотой, которая приводит к образованию соли и выделению водорода. В такой реакции металл выступает в роли основания, поглощающего протон от кислоты, а кислота - в роли кислоты, отдавая протон металлу.
Процесс нейтрализации металлом кислоты может проходить как в водных растворах, так и в твердых веществах. Он основан на принципе обмена протонами между металлом и кислотой. Металл, обладающий высокой активностью, может нейтрализовать даже сильные кислоты, такие как серная или хлорная, с образованием солей и выделением водорода. Такие реакции широко применяются в промышленности и лаборатории для получения солей и газовых продуктов.
Примером такой реакции может служить реакция между цинком и серной кислотой: Zn + H2SO4 -> ZnSO4 + H2. В результате этой реакции образуется сульфат цинка и выделяется молекулярный водород.
Металл-кислотная реакция нейтрализации имеет большое значение в химии и является одной из основных реакций для получения солей и газовых продуктов. Принципы этой реакции позволяют определить активность металла и кислоты и применить их в различных областях науки и технологии.
Что такое металл-кислотная реакция нейтрализации?
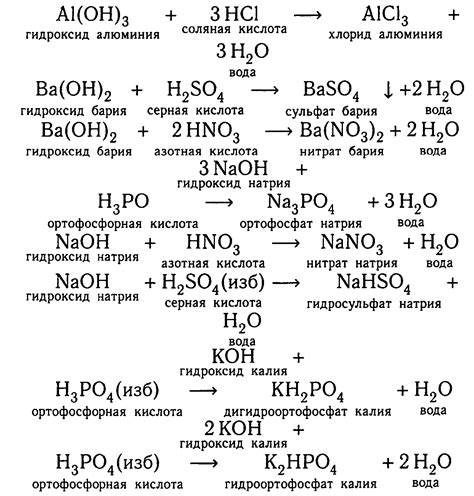
Металл-кислотная реакция нейтрализации представляет собой химическую реакцию между металлом и кислотой, в результате которой образуются соль и вода. Такая реакция подчиняется закону сохранения массы и может протекать только при определенных условиях.
В металл-кислотной реакции нейтрализации металл становится окислителем, а кислота указывает наличие протона – иона водорода, который выступает в роли восстановителя. Под действием кислоты металл отдаёт электроны, что приводит к его окислению. Свободные ионы металла реагируют с ионами водорода, образуя соль и молекулы воды.
При этом реакции нейтрализации между металлами и кислотами различаются по интенсивности процесса и скорости образования солей и воды. Реакция может протекать как быстро, так и медленно, в зависимости от химических свойств металла и кислоты, а также от условий проведения реакции.
Металл-кислотные реакции нейтрализации имеют широкое применение в различных областях, включая промышленность, научные исследования и бытовую сферу. Они играют важную роль в процессах очистки воды, производстве солей и других химических веществ, а также в создании различных продуктов и материалов с определенными свойствами.
Принципы металл-кислотной реакции нейтрализации

Металл-кислотная реакция нейтрализации - это химическая реакция между металлом и кислотой, в результате которой образуется соль и выделяется водород.
Основные принципы такой реакции:
- Процесс диссоциации кислоты. Первым этапом металл-кислотной реакции нейтрализации является диссоциация кислоты, то есть ее разложение на ионы. Кислота обычно содержит водород, который отделяется в форме положительно заряженных ионов (протонов).
- Реакция обмена. Вторым этапом является реакция обмена между металлическими ионами и ионами водорода из кислоты. Металлические ионы отдают свои электроны и образуют соль, а протоны от кислоты принимают эти электроны, образуя молекулярный водород.
- Образование соли. В результате металл-кислотной реакции нейтрализации образуется соль. Соль состоит из катиона металла и аниона оставшейся части кислоты. Формула соли зависит от видов металла и кислоты, участвующих в реакции.
- Выделение водорода. Последним этапом металл-кислотной реакции нейтрализации является выделение молекулярного водорода. Водород выделяется в виде газа и может быть обнаружен с помощью проведения эксперимента, например, при наложении внешнего источника открытого огня. Водород является одним из признаков металл-кислотной реакции.
Металл-кислотная реакция нейтрализации широко используется в химической промышленности и в лабораторных условиях для получения различных солей и других продуктов. Множество примеров таких реакций можно найти в химических учебниках и справочниках.
Как происходит металл-кислотная реакция нейтрализации?

Металл-кислотная реакция нейтрализации - это химическая реакция, которая происходит между металлом и кислотой. Во время этой реакции ионы металла реагируют с ионами водорода в кислоте, образуя соль и выделяя водород. Нейтрализация происходит, когда количество ионов водорода, отданных кислотой, равно количеству ионов металла.
Металл-кислотные реакции нейтрализации происходят на основе теории сопротивления кислоты. Кислота является жидкостью или раствором, который содержит ионы водорода и способен отдавать их при реакции с металлом. Металл, в свою очередь, может принять эти ионы и образовать соль.
При металл-кислотной реакции нейтрализации металл активно реагирует с кислотой, вытесняя водород. В результате образуется соль металла и вода. Это объясняется тем, что металл вступает во взаимодействие с ионами водорода, которые присутствуют в растворе кислоты.
Примеры металл-кислотных реакций нейтрализации включают реакцию между цинком и соляной кислотой, алюминием и серной кислотой или магнием и хлороводородной кислотой. Эти реакции могут быть использованы в различных промышленных и лабораторных процессах для получения различных продуктов.
Общая формула металл-кислотной реакции нейтрализации может быть записана следующим образом: металл + кислота → соль + водород. Эта реакция является обратимой и может быть описана с помощью химических уравнений соответствующих реагентов и продуктов.
Химические свойства металл-кислотных соединений

Металл-кислотные соединения, образующиеся в результате реакции нейтрализации между металлом и кислотой, обладают определенными химическими свойствами.
Во-первых, металл-кислотные соединения способны образовывать растворы, которые, в зависимости от конкретной пары "металл-кислота", могут быть кислотными, щелочными или нейтральными. Кроме того, растворы данных соединений обычно являются электролитами, то есть способны проводить электрический ток.
Во-вторых, металл-кислотные соединения обладают специфическими реакционными свойствами. Например, они могут взаимодействовать с другими реагентами и образовывать новые соединения. Также металл-кислотные соединения могут проявлять свойства окислителей или восстановителей, что связано с возможностью передачи электронов между их компонентами.
Третье химическое свойство металл-кислотных соединений связано с их способностью реагировать с веществами, обладающими базическими свойствами. Такие реакции приводят к образованию солей, которые могут иметь различные физические и химические свойства: быть кристаллическими, растворимыми или нерастворимыми в воде, ионными или молекулярными.
В заключение, металл-кислотные соединения являются важными объектами химических исследований. Изучение их химических свойств позволяет понять особенности реакций нейтрализации, а также разработать новые материалы и технологии в различных областях промышленности и науки.
Важность металл-кислотной реакции нейтрализации в промышленности

Металл-кислотная реакция нейтрализации является важным процессом в промышленности и имеет широкое применение в различных отраслях. Она позволяет регулировать pH среды, обеспечивая оптимальные условия для проведения множества процессов.
Одним из основных применений металл-кислотной реакции нейтрализации является очистка сточных вод в промышленных предприятиях. В процессе производства различных товаров и продуктов отходы и загрязнения попадают в воду, что может привести к серьезным экологическим проблемам. Металл-кислотная реакция нейтрализации позволяет не только снизить уровень кислотности сточных вод, но и выпадение тяжелых металлов в инертную форму.
Кроме того, металл-кислотная реакция нейтрализации применяется в производстве различных химических соединений. Например, при производстве удобрений используется реакция нейтрализации для получения необходимых элементов в доступной форме для растений. Эта реакция позволяет регулировать pH почвы и обеспечить оптимальные условия для роста растений.
Также металл-кислотная реакция нейтрализации играет важную роль в производстве металлов. Нейтрализация кислоты, получаемой при выделении металлов из руды, является неотъемлемым этапом процесса. Она позволяет избавиться от опасных соединений, таких как серная кислота, а также обеспечить стабильность pH среды для проведения дальнейших операций.
Таким образом, металл-кислотная реакция нейтрализации имеет огромную важность в промышленности. Она позволяет не только обеспечить оптимальные условия для проведения различных процессов, но и помогает защитить окружающую среду от загрязнения. Этот процесс приобретает все большую значимость в условиях стремительного развития промышленности и растущей необходимости в эффективном использовании ресурсов.
Примеры металл-кислотных реакций нейтрализации

Металл-кислотные реакции нейтрализации – это химические реакции, при которых ионы металла образуют с лишними ионами водорода соль и вода. Приведем несколько примеров таких реакций.
1. Реакция нейтрализации алюминия с соляной кислотой:
- Al + HCl → AlCl3 + H2
2. Реакция нейтрализации железа с серной кислотой:
- Fe + H2SO4 → FeSO4 + H2
3. Реакция нейтрализации магния с уксусной кислотой:
- Mg + CH3COOH → Mg(CH3COO)2 + H2
4. Реакция нейтрализации цинка с серной кислотой:
- Zn + H2SO4 → ZnSO4 + H2
5. Реакция нейтрализации меди с соляной кислотой:
- Cu + 2HCl → CuCl2 + H2
6. Реакция нейтрализации свинца с азотной кислотой:
- Pb + 4HNO3 → Pb(NO3)2 + 2H2O + 2NO2
7. Реакция нейтрализации кадмия с уксусной кислотой:
- Cd + 2CH3COOH → Cd(CH3COO)2 + H2
Это лишь некоторые из многочисленных примеров металл-кислотных реакций нейтрализации, которые происходят в химических процессах, промышленности и в живых организмах.
Вычисление реакционных реализаций металлидов и кислот
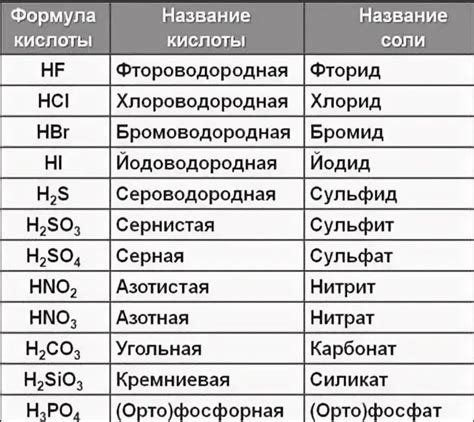
Металл-кислотная реакция нейтрализации возникает при взаимодействии металлидов и кислот. Для вычисления реакционных реализаций необходимо знать химические формулы металлида и кислоты, а также их стехиометрические соотношения.
В химическом уравнении металлида и кислоты реагенты указываются слева от стрелки, а продукты - справа. Перед каждым реагентом и продуктом указывается его коэффициент (стехиометрический коэффициент), который показывает, в каких пропорциях происходит реакция.
Реакционные реализации металлидов и кислот могут происходить по разным типам, включая образование соли, выделение газа или образование воды. Например, при взаимодействии металлида натрия (Na) и кислоты соляной (HCl) образуется соль хлорида натрия (NaCl) и выделяется газ водород (H2). Химическое уравнение для этой реакции выглядит следующим образом:
| HCl + Na → NaCl + H2 |
Для вычисления реакционных реализаций металлидов и кислот также необходимо учитывать коррекцию стехиометрических коэффициентов, согласно закону сохранения массы и заряда.
Изучение реакций нейтрализации металлидов и кислот является важным аспектом химической науки и применяется во множестве областей, включая промышленность, медицину и экологию.
Применение металл-кислотной реакции нейтрализации в повседневной жизни

Металл-кислотная реакция нейтрализации является одной из основных реакций в химии. Она применяется не только в лабораториях и научных исследованиях, но и в нашей повседневной жизни. Дело в том, что кислоты и щелочи, которые взаимодействуют в этой реакции, широко распространены в нашем окружении.
Одним из наиболее распространенных примеров применения металл-кислотной реакции нейтрализации является повседневное домашнее задание - мытье посуды. При помощи щелочных моющих средств (например, соды или моющего порошка) мы нейтрализуем кислотные остатки и жировые пятна, которые могут содержаться на посуде после приготовления пищи.
Еще одним примером применения металл-кислотной реакции нейтрализации является использование антацидов для облегчения желудочной и кишечной неприятности, связанной с избытком соляной кислоты в желудке. Антациды, такие как магнезия гидроксид, нейтрализуют кислоту и помогают уменьшить или устранить симптомы изжоги или диспепсии.
Интересный пример применения металл-кислотной реакции нейтрализации - использование гидроксида алюминия или металлической алюминиевой фольги для удаления отложений ржавчины на металлических поверхностях или украшениях. Алюминий реагирует с кислотой (например, соляной кислотой) и образует соль и воду, помогая при этом очистить поверхность от ржавчины.
Описанные примеры лишь небольшая часть того, как металл-кислотная реакция нейтрализации применяется в повседневной жизни. От моющих средств до медицинских препаратов - кислотно-щелочные реакции играют важную роль в поддержании нашего комфорта и благополучия.
Вопрос-ответ

Что такое металл-кислотная реакция нейтрализации?
Металл-кислотная реакция нейтрализации - это химическая реакция между кислотой и металлом, в результате которой образуется соль и выделяется водород.
Какие могут быть примеры металл-кислотных реакций нейтрализации?
Примером металл-кислотной реакции нейтрализации является реакция между хлороводородом (кислота) и цинком (металл), при которой образуется хлорид цинка и выделяется водородный газ. Другим примером может быть реакция между серной кислотой и железом, при которой образуется сульфат железа и выделяется водород.
