Металл галогеновых веществ является одним из наиболее важных классов химических соединений. Он образуется при электролизе раствора солей галогенов, таких как хлориды, бромиды и иодиды. Металлы галогеновых веществ обладают высокой химической активностью и широким спектром применения в различных областях науки и техники.
Формула металл галогеновых веществ зависит от конкретного галогена. Например, металл хлоридов имеет формулу MCl, где M обозначает металл (например, натрий - Na, калий - K). Металл бромидов обозначается как MBr, а металл иодидов - MI. Это позволяет установить связь между металлическим и галогенидным ионами.
Структура металл галогеновых веществ также определяется характером связи между металлом и галогеном. Во многих случаях, металл галогеновых веществ образует ионную сеть, где металлические ионы окружены галогенидными ионами. В некоторых случаях, таких как газообразные металл галогениды, структура может быть молекулярной, где металлический и галогенидный ионы образуют межмолекулярные связи.
Структура металл галогеновых веществ
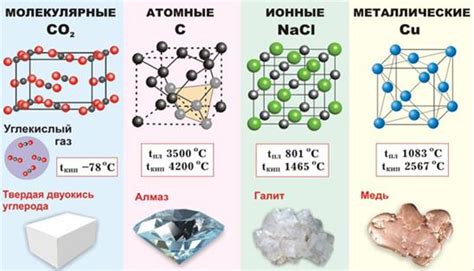
Металл галогеновые вещества представляют собой соединения, включающие в себя металл из группы 1 (щелочные металлы) и галоген из группы 17 (фтор, хлор, бром, йод). Они образуют ионные соединения, где металл отдаёт один электрон галогену, образуя положительный ион металла и отрицательный ион галогена.
Структура металл галогеновых веществ может быть описана с помощью кристаллической решётки, где положительные ионы металла расположены в узлах, а отрицательные ионы галогена окружают их. Каждый ион галогена окружен шестью ионами металла, образуя октаэдрическую геометрию. Данная структура обеспечивает стабильность соединения и позволяет образовывать кристаллы с определенными свойствами.
Металл галогеновые вещества обладают высокой растворимостью в воде и других полярных растворителях, так как водородные связи между положительными ионами металла и отрицательными ионами галогена облегчают их разделение. Более того, они обладают высокой термической и электрической проводимостью, что делает их полезными в различных промышленных процессах.
Важно отметить, что структура металл галогеновых веществ может быть изменена под воздействием различных условий, например, температуры и давления. Это может привести к изменению свойств соединений и открытию новых областей их применения. Изучение структуры и свойств металл галогеновых веществ имеет важное практическое значение для разработки новых материалов и технологий.
Формула металл галогеновых веществ
Металл галогеновых веществ представляет собой химическое соединение между металлом и галогеном. Оно обладает своей характерной формулой, которая позволяет установить пропорции между атомами металла и галогена в соединении.
Сама формула металл галогенового вещества состоит из символов, обозначающих химический элемент металла и галогена, а также цифр, указывающих количество атомов каждого элемента в соединении. Например, для соединения между натрием (Na) и хлором (Cl) формула будет выглядеть как NaCl, что означает, что в каждом соединении на один атом натрия приходится один атом хлора.
Формула металл галогеновых веществ может быть представлена не только в простой форме, но и в виде химической реакции или структурной формулы. Например, формула металл галогенового вещества между натрием и хлором может быть представлена как химическая реакция: Na + Cl → NaCl.
Знание формул металл галогеновых веществ позволяет химикам предсказывать и описывать свойства соединений, а также проводить различные расчеты и эксперименты. Кроме того, формула металл галогенового вещества является основой для назначения имен соединению и его классификации в химической систематике.
Молекулярная структура металл галогеновых веществ
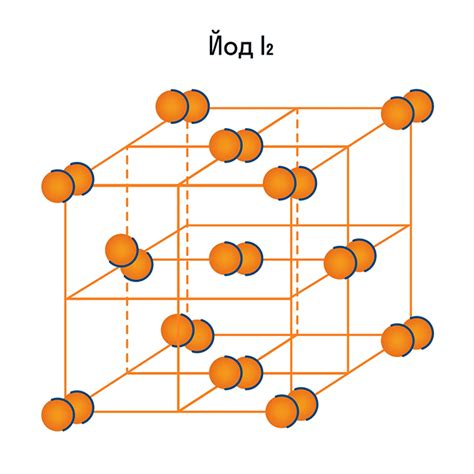
Металл галогеновые вещества, полученные при электролизе, обладают особой молекулярной структурой, которая определяет их химические и физические свойства. Эти вещества представляют собой соединения металлов с галогенами – флуором, хлором, бромом или йодом.
Молекулы металл галогеновых веществ состоят из одного атома металла, который атомно связан с одной или более молекулами галогена. Такая структура обеспечивается силой кулоновского взаимодействия между положительно заряженными и отрицательно заряженными ионами металла и галогена.
Особенностью молекулярной структуры металл галогеновых веществ является их полюсность. Так, молекулы флуоридов и хлоридов металлов обладают полярной связью из-за разницы в электроотрицательности металла и галогена. В результате этой полярности, металл галогеновые вещества проявляют различные свойства, такие как высокая электроотрицательность, способность к образованию ионов и возможность образования сильных химических связей.
Молекулярная структура металл галогеновых веществ также может варьироваться в зависимости от типа металла и галогена. Например, молекулы бромидов и йодидов металлов имеют больший размер по сравнению с флуоридами и хлоридами, что приводит к образованию более слабых связей и более низким температурам кипения этих веществ.
В целом, молекулярная структура металл галогеновых веществ является важным аспектом их свойств и влияет на их применение в различных областях, таких как химия, электроника и катализ.
Атомная структура металл галогеновых веществ
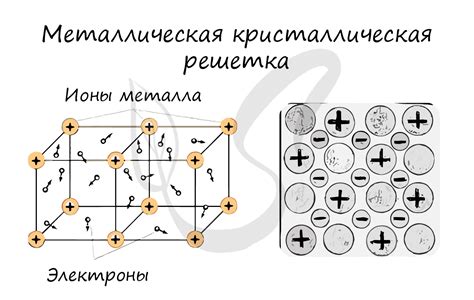
Металл галогеновые вещества являются соединениями металлов и галогенов, таких как фтор, хлор, бром и йод. В результате электролиза, металлы передают электроны галогенам, образуя ионные связи. Это означает, что атомы металла становятся положительно заряженными ионами (катионами), в то время как атомы галогена становятся отрицательно заряженными ионами (анионами).
Структура металл галогеновых веществ обычно представляет собой кристаллическую решетку, в которой ионы металла и галогена располагаются в определенном порядке. Наиболее распространенной структурой является кубическая кристаллическая решетка, где ионы металла и галогена расположены в узлах кубической решетки.
Каждый ион металла окружен положительно заряженными ионами галогена, а каждый ион галогена окружен отрицательно заряженными ионами металла. Эти ионы образуют устойчивую структуру, что делает металл галогеновые вещества стабильными и реакционноспособными.
Формула металл галогеновых веществ указывает на число и тип атомов каждого элемента, присутствующих в соединении. Например, NaCl обозначает хлорид натрия, где N означает натрий (металл) и Cl означает хлор (галоген). Такая формула указывает, что вещество содержит один атом натрия и один атом хлора, которые связаны ионной связью.
Ионная структура металл-галогеновых веществ
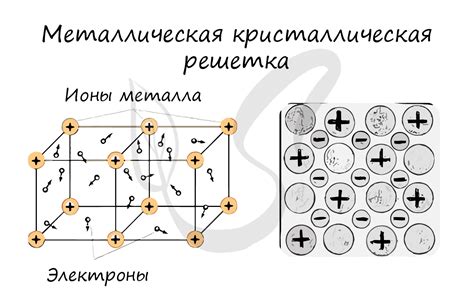
Металл-галогеновые вещества представляют собой химические соединения, состоящие из металлического катиона и галогенидного аниона. Металлы обладают положительным зарядом и отдают электроны, чтобы стать ионами. Галогены, в свою очередь, имеют высокую электроотрицательность и принимают электроны, образуя отрицательные анионы.
Ионная структура металл-галогеновых веществ определяется взаимодействием катионов и анионов. Катионы и анионы образуют кристаллическую решетку, где положительные и отрицательные ионы располагаются таким образом, чтобы минимизировать электростатическое отталкивание и максимизировать притяжение между ними.
В ионной структуре металл-галогеновых соединений металлический катион обычно окружен галогенидными анионами. Количество анионов, окружающих катион, зависит от радиуса катиона и аниона, а также от ионной радиус-зарядовое отношение.
Ионная структура металл-галогеновых веществ может быть представлена в виде таблицы, где указывается количество галогенидных анионов, окружающих каждый катион. Пример такой таблицы:
| Металл | Анион | Количество анионов вокруг катиона |
|---|---|---|
| Натрий (Na) | Хлор (Cl) | 6 |
| Калий (K) | Бром (Br) | 6 |
| Ртуть (Hg) | Фтор (F) | 2 |
Таким образом, ионная структура металл-галогеновых веществ описывает организацию металлических и галогенидных ионов в кристаллической решетке и играет важную роль в определении их физических и химических свойств.
Вопрос-ответ

Какая структура у металл галогеновых веществ, полученных при электролизе?
Металл галогеновых веществ, полученных при электролизе, обычно имеют форму металлических кристаллов. Эти вещества обладают высокой степенью упорядоченности атомов и могут образовывать сложные кристаллические решетки.
Какова формула металл галогеновых веществ, полученных при электролизе?
Формула металл галогеновых веществ, полученных при электролизе, зависит от конкретного металла и галогена. Например, у металла натрия и хлора формула вещества будет NaCl, у металла калия и брома - KBr, а у металла магния и йода - MgI2. В общем случае, формула такого вещества будет следующей: МхУу, где М - металл, У - галоген, x и y - коэффициенты, обеспечивающие нейтральность вещества.
Какие есть методы получения металл галогеновых веществ путем электролиза? Какова их структура и формула?
Существует несколько методов получения металл галогеновых веществ путем электролиза. Один из них - электролиз расплавов галогенидов металлов. В этом случае, при помощи электролиза, из расплава галогенида металла выделяется металл. Например, из расплава хлорида натрия (NaCl) получается металлический натрий (Na). Структура такого металла представляет собой кристаллические решетки, где атомы натрия упорядочены. Формула металлицеского натрия - Na. В общем случае, формула металлического галогенида будет М, где М - металл.
