Амфотерные оксиды представляют собой класс веществ, которые обладают способностью проявлять как кислотные, так и щелочные свойства. В данной статье мы рассмотрим металл амфотерный оксид, который является одним из представителей этого класса и обладает уникальными свойствами и реакциями.
Металл амфотерный оксид представляет собой соединение, в состав которого входит металл и кислород. Он может проявлять как кислотные, так и щелочные свойства в зависимости от условий реакции. Если взаимодействие с водой происходит в кислой среде, то металл амфотерный оксид будет проявлять кислотные свойства, а если в щелочной среде - щелочные свойства.
Металл амфотерный оксид также проявляет реакцию с кислотами и основаниями. В реакции с кислотами он действует как основание, принимая на себя протоны от кислоты. В реакции с основаниями он, напротив, действует как кислота, отдавая протоны основанию.
Примером металла амфотерного оксида может служить оксид алюминия (Al2O3). В кислой среде он проявляет кислотные свойства, реагируя с водой и образуя кислоту. В щелочной среде же оксид алюминия будет проявлять щелочные свойства, образуя алюминат.
Металл амфотерный оксид является важным составляющим многих химических соединений и используется в различных областях, включая металлургию, катализ и производство электроники. Его свойства и реакции исследуются учеными для разработки новых материалов и веществ с уникальными свойствами и возможностями применения.
Физические свойства

Металл амфотерный оксид обладает рядом характеристических физических свойств, которые определяют его поведение и реакцию в различных условиях. Во-первых, данный оксид обладает высокой температурной стабильностью, что позволяет ему сохранять свою форму и структуру при высоких температурах. Это свойство делает его полезным материалом для использования в высокотемпературных условиях, например, в аэрокосмической и энергетической отраслях.
Во-вторых, металл амфотерный оксид имеет высокую плотность, что делает его тяжелым и прочным материалом. Это свойство позволяет ему выдерживать большие механические нагрузки и делает его идеальным материалом для использования в строительстве и машиностроении.
Кроме того, данный оксид обладает низкой проводимостью тепла, что означает, что он плохо передает тепло. Это свойство может быть использовано в различных приложениях, например, для изготовления теплоизоляционных материалов или элементов, предотвращающих перегрев приборов.
Наконец, металл амфотерный оксид обладает высокими электропроводными свойствами, что делает его отличным материалом для использования в электронике и электротехнике. Благодаря этим свойствам, его можно использовать в проводниках, контактах и различных электронных компонентах, где требуется хорошая электрическая проводимость.
Химические свойства

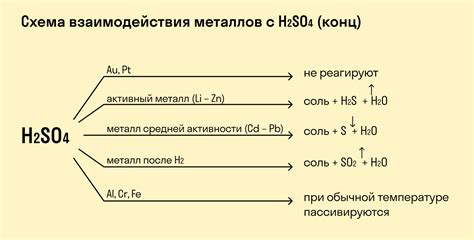
Амфотерные свойства. Металлические амфотерные оксиды проявляют способность проявлять химическую активность как в щелочных средах, так и в кислотных. Они могут образовывать соли как с кислыми оксидами, так и с основными. Примером амфотерного металлического оксида может служить окись алюминия (Al2O3), которая реагирует и с щелочами, и с кислотами.
Реакция с кислотами. Металлические амфотерные оксиды образуют соли при реакции с кислотами. При этом происходит образование солей, воды и осадка. Например, окись цинка (ZnO) реагирует с соляной кислотой (HCl), образуя хлорид цинка (ZnCl2) и воду.
Реакция с щелочами. Металлические амфотерные оксиды также могут реагировать с щелочами. При этом образуются соли гидроксидов металлов и вода. Например, окись железа (Fe2O3) реагирует с гидроксидом натрия (NaOH), образуя соль гидроксида железа (Fe(OH)3) и воду.
Реакция с оксидами. Металлические амфотерные оксиды способны образовывать соли при реакции с кислыми оксидами и основными оксидами. При этом образуются соли и вода. Например, окись магния (MgO) реагирует с оксидом серы (SO3), образуя сульфат магния (MgSO4).
Таким образом, металл амфотерный оксид обладает свойством проявлять химическую активность как в щелочных средах, так и в кислотных. Он может реагировать с кислотами, щелочами и оксидами, образуя соли и воду. Эти свойства делают амфотерные оксиды важными в различных химических реакциях и процессах в природе и промышленности.
Реакции с кислотами
Амфотерные оксиды имеют способность взаимодействовать с кислотами. В зависимости от условий, они могут реагировать с различными кислотами, в том числе сильными и слабыми.
Когда амфотерный оксид взаимодействует с сильной кислотой, происходит нейтрализационная реакция. В результате этой реакции образуется соль и вода. Например, оксид железа(III) Fe2O3 реагирует с соляной кислотой HCl, образуя соль хлорида железа(III) FeCl3 и воду:
- Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Когда амфотерный оксид взаимодействует со слабой кислотой, происходит реакция амфотерности. В результате этой реакции образуются соль слабой кислоты и вода. Например, оксид цинка ZnO реагирует с уксусной кислотой CH3COOH, образуя ацетат цинка Zn(CH3COO)2 и воду:
- ZnO + 2CH3COOH → Zn(CH3COO)2 + H2O
Реакции амфотерных оксидов с кислотами являются важным аспектом их химического свойства. Эти реакции позволяют использовать амфотерные оксиды в различных процессах, таких как нейтрализация и образование солей.
Реакции с щелочами
Амфотерный оксид – это вещество, которое может реагировать как с кислотами, так и с щелочами. Реакция амфотерного оксида с щелочью происходит в результате образования соли и воды.
Когда металлический амфотерный оксид взаимодействует с щелочью, образуется соль и вода. Для этой реакции характерно образование гидроксо-ионов, которые включают металл и гидроксидную группу.
Например, оксид алюминия – амфотерный оксид, который может реагировать как с кислотами, так и с щелочами. При взаимодействии оксида алюминия с щелочью, образуется соль алюминия и вода:
- Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O
Эта реакция приводит к образованию гидроксида алюминия, который является основным компонентом щелочного раствора.
Реакция амфотерного оксида с щелочью происходит с выделением тепла. Отрицательный заряд в амфоле металла и положительный заряд в гидроксильной группе компенсируются, образуя нейтральные соединения – соли.
Вопрос-ответ

Что такое амфотерные оксиды?
Амфотерные оксиды - это химические соединения, которые могут реагировать и с кислотами, и с щелочами. Это связано с их способностью выступать и как оксиды металлов, и как основания.
Какие свойства характеризуют металлы-амфотерные оксиды?
Основные свойства металлов-амфотерных оксидов - это их способность реагировать с кислотами и щелочами. Также они характеризуются высокой электропроводностью и обладают металлическим блеском. Некоторые из них, например, оксид алюминия, обладают также высокой термической стабильностью.
