Металл аффинная хроматография является важным методом разделения и очистки белков и других биологических молекул. Она основана на специфической взаимодействии между металлическими ионами и целевыми молекулами. Этот метод широко используется в биохимии, биотехнологии и фармацевтической промышленности.
Принцип металл аффинной хроматографии состоит в использовании аффинного взаимодействия между металл и целевой молекулой. Обычно в качестве металлического иона используется ион никеля, цинка, меди или кобальта. Целевые молекулы, которые могут быть улавливаемыми металлами, включают гистидинсодержащие белки, пептиды, нуклеотиды и другие соединения, содержащие ионный металл.
Металл аффинная хроматография широко применяется для очистки и концентрации целевых молекул из смеси. Она особенно полезна в случаях, когда необходимо удалить примеси и снизить концентрацию нежелательных соединений. Также данный метод позволяет получать белки с высокой степенью очистки и сохранять их активность.
Преимущества металл аффинной хроматографии:
1. Высокая специфичность очистки целевых молекул;
2. Возможность использования как в условиях нормальной, так и обратной фазы;
3. Легкость масштабирования и многократного использования матриц связывания металлов;
4. Широкий спектр применения в различных областях науки и промышленности.
Итак, металл аффинная хроматография является мощным инструментом для очистки и разделения целевых молекул, таких как белки и нуклеотиды. Она используется в различных областях науки и промышленности, обеспечивая высокую степень очистки и сохранение активности целевых молекул. Применение этого метода может значительно облегчить процесс изучения и производства биологических молекул, а также улучшить качество конечного продукта.
Принципы металл аффинной хроматографии
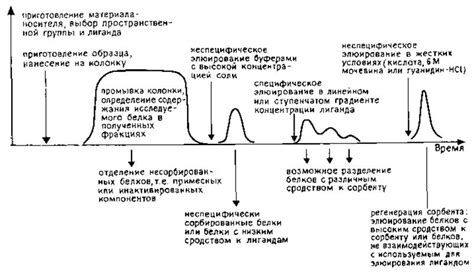
Металл аффинная хроматография (МАХ) основана на взаимодействии металлических ионов с белками и нуклеиновыми кислотами. Принцип работы МАХ заключается в использовании специальных сорбентов, на которых присутствуют функциональные группы, способные образовывать координационные комплексы с ионами металлов.
В МАХ белки или нуклеиновые кислоты, содержащие аминокислотные остатки или нуклеотиды способные образовывать комплексы с металлами, могут быть селективно извлечены из смеси. При проведении хроматографии, проба смешивается с сорбентом, и затем путем промывания и элюции можно получить чистые продукты на выходе.
Металл аффинная хроматография особенно полезна при очистке белков или нуклеиновых кислот, которые обладают специфическими свойствами координационных комплексов с металлами. Например, железосодержащие белки могут быть изолированы с использованием железосвязывающих колонок.
Выбор металлического иона как скелета

Металлические ионы часто используются в качестве скелета при проведении металлоаффинной хроматографии. Выбор металлического иона зависит от ряда факторов, включая цель исследования, физико-химические свойства и интересующие соединения.
Одним из ключевых факторов при выборе металлического иона является его аффинность к целевым соединениям. Ионы должны обладать достаточной аффинностью, чтобы удерживать интересующие соединения в процессе хроматографии, но при этом не слишком сильной, чтобы была возможность их последующего выделения.
Кроме того, важно учитывать степень стабильности ионообменника, а также его стойкость к различным кислотам и основаниям. Это обеспечивает долговечность и эффективность процесса хроматографии.
Также следует учитывать доступность металлических ионов, их стоимость и возможность масштабирования процесса хроматографии при использовании выбранного иона.
Итак, выбор металлического иона как скелета в металлоаффинной хроматографии является комплексным процессом, включающим анализ физико-химических свойств и аффинности металла к целевым соединениям, а также учет факторов экономической и технической целесообразности.
Взаимодействие с белками и нуклеиновыми кислотами
Металл аффинная хроматография - это метод, который основан на использовании аффинных взаимодействий металл-лигандных соединений с целевыми молекулами, такими как белки и нуклеиновые кислоты. Эти аффинные взаимодействия основаны на специфическом связывании между металлическим ионом и определенными функциональными группами на молекуле.
При использовании металл аффинной хроматографии для изоляции и очистки белков и нуклеиновых кислот, специально подобранные металл-лигандные соединения привязываются к матрице хроматографической колонки. После загрузки образца на колонку, целевые молекулы связываются с металл-лигандным соединением, позволяя остальным молекулам быстро проходить через колонку. Затем связанные молекулы элюируются из колонки с использованием различных элюционных буферов, которые конкурируют с аффинным взаимодействием между металл-лигандным соединением и целевыми молекулами.
Металл аффинная хроматография широко используется для исследования белков и нуклеиновых кислот в биохимических и биологических исследованиях. Она позволяет изолировать чистые образцы целевых молекул, удаляя примеси и другие компоненты. Этот метод также может быть использован для изучения взаимодействий между различными белками и нуклеиновыми кислотами, исследуя их аффинные связи и специфичность.
Применение металл-аффинной хроматографии

Металл-аффинная хроматография широко применяется в биохимических и биомедицинских исследованиях для изучения взаимодействия белков с металлами. Этот метод позволяет очищать и изолировать белки, которые образуют стабильные комплексы с определенными металлами.
Металл-аффинная хроматография особенно полезна при изучении металлопротеинов, таких как ферменты, транспортные и регуляторные белки, которые играют важную роль в многих биологических процессах. С помощью этого метода можно выделить специфичные металлопротеины из сложной смеси других белков и компонентов.
Применение металл-аффинной хроматографии также распространено в различных областях биотехнологии, включая производство и очистку рекомбинантных белков. Этот метод позволяет эффективно избирательно связывать целевые белки на специально модифицированных смолах или микрочастицах, что обеспечивает их концентрацию и очистку от нежелательных примесей.
Еще одной областью применения металл-аффинной хроматографии является исследование взаимодействия лекарственных препаратов с белками-мишенями. Этот метод позволяет анализировать и оценивать аффинность и специфичность взаимодействия лекарственных препаратов с металлсодержащими белками, что может быть полезным при разработке новых лекарственных средств.
Изоляция и очистка белков

Изоляция и очистка белков – это важные шаги в биологических и биохимических исследованиях, которые позволяют избавиться от примесей и концентрировать интересующий нас белок. Они выполняются с помощью различных методов, в том числе и с использованием металл аффинной хроматографии.
Металл аффинная хроматография основана на взаимодействии металлической матрицы, обычно септиновая колонка с иммобилизированными ионами металла, с белками, содержащими аффинность к этим ионам. Наиболее часто используемыми металлами для аффинной хроматографии являются никель, кобальт и золото.
Процесс изоляции и очистки белков с помощью металл аффинной хроматографии состоит из нескольких шагов. Вначале белковая смесь проходит через колонку, где происходит связывание белков с иммобилизированными ионами металла. Затем колонка промывается для удаления несвязанных белков и примесей. После этого происходит элюция связанных белков с помощью изменения состава ионного буфера или понижения или повышения pH. Элюиро-собранные белки могут быть дальнейшеем использованы в различных биохимических анализах и исследованиях.
Изучение взаимодействия белков с другими молекулами

Изучение взаимодействия белков с другими молекулами является важной задачей в биохимии и биологии. Белки выполняют множество функций в организме, и для понимания их работы необходимо понять, как они взаимодействуют с другими молекулами.
Для изучения взаимодействия белков с другими молекулами используются различные методы и техники. Одним из таких методов является металл аффинная хроматография. Этот метод основан на способности определенных металлов связываться с белками через их аффинное взаимодействие.
Суть металл аффинной хроматографии состоит в следующем. На стационарную фазу хроматографической колонки наносятся специальные сорбенты, содержащие селективные металлы, такие как никель, кобальт или цинк. Затем проба, содержащая смесь белков, подается на колонку. Белки, обладающие способностью связываться с данным металлом, удерживаются на стационарной фазе, в то время как остальные компоненты пробы проходят через колонку.
После удержания белка на стационарной фазе может быть проведена дальнейшая хроматографическая очистка или анализ. Также возможно проведение дальнейших исследований для выяснения природы и силы взаимодействия между белком и металлом, в том числе использование спектроскопических методов или других методов структурного анализа.
Металл аффинная хроматография широко используется в биологических и медицинских исследованиях для изучения взаимодействия белков с другими молекулами, такими как лекарственные препараты или другие биомолекулы. Этот метод позволяет не только изучать аффинное взаимодействие белка с металлом, но и использовать его для очистки и выделения белков из сложных смесей.
Изучение структуры и функций нуклеиновых кислот
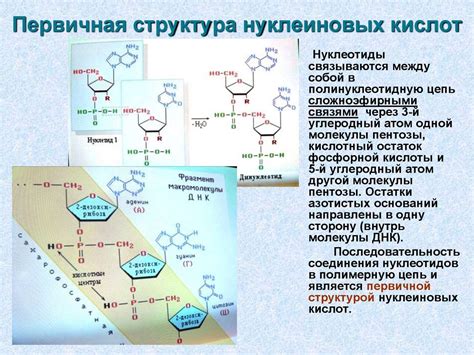
Нуклеиновые кислоты - это полимеры, состоящие из нуклеотидных мономеров. Они являются основными молекулами, ответственными за хранение, передачу и экспрессию генетической информации в клетке. Изучение структуры и функций нуклеиновых кислот имеет огромное значение для понимания механизмов генной регуляции, развития заболеваний и разработки новых лекарственных препаратов.
Одним из методов, используемых для исследования нуклеиновых кислот, является электрофорез. Этот метод позволяет разделять нуклеотиды на основе их электрического заряда и размера. Электрофорез позволяет определить длину, структуру и содержание нуклеотидов в образце.
Для более точного изучения структуры нуклеиновых кислот используется рентгеновская кристаллография. Этот метод позволяет определить трехмерную структуру нуклеиновых кислот на атомном уровне. Рентгеновская кристаллография позволяет увидеть, как атомы входят в состав нуклеотидов и как они взаимодействуют друг с другом.
Помимо электрофореза и рентгеновской кристаллографии, также широко применяются методы ядерного магнитного резонанса (ЯМР) и масс-спектрометрия для изучения структуры и функции нуклеиновых кислот. ЯМР позволяет определить взаимодействия и конформацию молекулы, а масс-спектрометрия - массу и состав нуклеотидов.
Применение различных методов изучения структуры и функций нуклеиновых кислот позволяет расширить наше понимание о механизмах генетической информации, а также разрабатывать новые методы лечения генетических заболеваний и разработки лекарственных препаратов.
Вопрос-ответ

Что такое металл аффинная хроматография?
Металл аффинная хроматография - это метод разделения и очистки белков и других молекул на основе их взаимодействия с металлическими ионообменными материалами. Он основан на способности металлов образовывать комплексы с определенными молекулами. Металл аффинная хроматография широко используется в биохимии и биотехнологии для очистки и изучения белков, а также для разделения ионов и других молекул.
Как работает металл аффинная хроматография?
Металл аффинная хроматография основана на взаимодействии молекул с металлическими ионообменными материалами. Для этого специальные материалы, обычно состоящие из железа, никеля или цинка, покрыты или связаны с определенными металлами или их соединениями. В ходе хроматографического процесса образца проходят через материал, и молекулы, которые образуют комплексы с металлическими ионами, задерживаются, в то время как остальные молекулы проходят дальше. После этого задержанные молекулы могут быть элюированы из материала путем изменения условий, например путем изменения pH или добавления соответствующих лигандов.
