Медь – это химический элемент с атомным номером 29 и символом Cu в периодической системе элементов. Она является одним из самых важных металлов в различных отраслях промышленности и строительства. Медь имеет широкий спектр свойств и характеристик, которые делают ее незаменимым материалом для многих приложений. В этой статье мы рассмотрим классификацию свойств меди и особенности щелочных металлов.
Свойства меди можно разделить на физические и химические. Физические свойства меди включают высокую электропроводность, теплопроводность и пластичность. Благодаря этим свойствам, медь широко используется в электротехнике, производстве проводов и кабелей, а также в строительстве и сантехнике. Химические свойства меди включают устойчивость к коррозии и окислению, а также необычную способность образовывать разнообразные соединения. Эти свойства делают медь ценным материалом для производства химических соединений и катализаторов.
Медь также относится к группе щелочных металлов, которые включают литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы имеют низкую плотность, низкую температуру плавления и высокую реактивность. Они являются необходимыми для поддержания жизни и важными элементами в биохимических процессах организма. Щелочные металлы широко используются в производстве щелочных батарей, промышленной химии и фармацевтики.
Понятие и значимость

Медь – это металлический химический элемент, расположенный в таблице Менделеева под номером 29. Она характеризуется блестящим красновато-желтым цветом и отличной электропроводимостью.
Медь является одним из самых старинных природных материалов, широко применяемых в производстве. Ее значимость заключается не только в сфере электротехники и связи, но и в строительстве, промышленности, химии и других отраслях.
Этот металл обладает рядом уникальных свойств, которые делают его незаменимым в различных областях. Благодаря хорошей электропроводимости, медь используется для создания электрических проводников, кабелей и печатных плат. Более того, она обладает высокой теплопроводностью, что делает ее идеальным материалом для радиаторов и теплообменников.
Медь также обладает антимикробными свойствами, что позволяет ей использоваться в медицине и бытовой сфере для создания антибактериальных поверхностей и изделий. Кроме того, медь вносит вклад в улучшение экологического состояния планеты, поскольку она является перерабатываемым материалом, что способствует уменьшению количества отходов и снижению нагрузки на окружающую среду.
Определение меди и ее использование

Медь – это химический элемент с атомным номером 29. Он относится к щелочным металлам и обладает высокой электропроводностью и теплопроводностью. Медь имеет хорошую коррозионную стойкость и привлекательный внешний вид.
Медь широко используется в различных отраслях промышленности. Одной из самых известных областей применения меди является электротехника. Благодаря своей высокой электропроводности, медь используется для создания проводников, кабелей и контактов. Она является ключевым материалом для передачи электрического тока.
Кроме того, медь также широко используется в производстве медных труб и теплообменников. Благодаря своей высокой теплопроводности, медь является идеальным материалом для транспорта и распределения тепла. Это особенно важно в системах отопления и кондиционирования воздуха.
Медь также применяется в производстве ювелирных изделий и монет. Ее привлекательный золотистый оттенок и прочность делают ее популярным материалом для создания украшений и монетного производства.
В дополнение к своему использованию в промышленности и ювелирном искусстве, медь также играет важную роль в медицине. Благодаря своим антимикробным свойствам, медь используется для создания антимикробных поверхностей, которые помогают предотвратить распространение бактерий и вирусов.
Таким образом, медь – это универсальный материал, который используется во многих отраслях промышленности и имеет широкий спектр применения от электротехники до медицины.
Физические свойства

Свойства меди, включающие ее физические характеристики, имеют большое значение в различных областях науки и техники. Одним из основных физических свойств меди является ее высокая электропроводность. Медь является одним из самых лучших проводников электричества и тепла. Благодаря этому свойству, медь широко используется в производстве электроники, электротехнике и энергетике.
Другим физическим свойством меди является ее высокая пластичность. Медь может быть легко вытянута в проволоку или прокатана в листы. Благодаря этому свойству, медь используется в производстве различных изделий, таких как провода, кабели, пластинки и трубы.
Также медь обладает высокой плотностью, что делает ее тяжелой и прочной. Это свойство меди позволяет использовать ее в производстве конструкционных деталей, таких как палки для гольфа и зажимы для волос. Кроме того, медь обладает хорошей устойчивостью к коррозии, что делает ее идеальным материалом для изготовления инженерных сооружений и судовых конструкций.
Таким образом, физические свойства меди, такие как высокая электропроводность, пластичность, плотность и устойчивость к коррозии, делают ее неотъемлемой частью различных отраслей промышленности и научных исследований.
Плотность и температура плавления
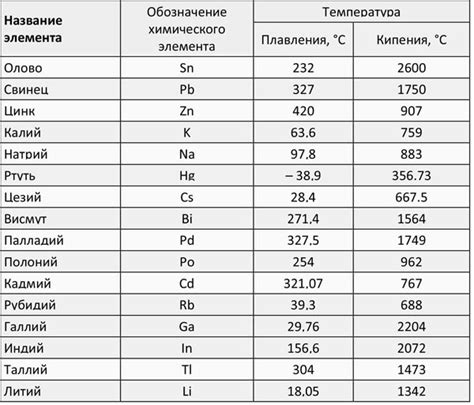
Плотность меди составляет около 8,92 г/см³, что делает ее одним из самых плотных металлов. Это свойство связано с близкой упаковкой атомов меди в решетке кристалла. Благодаря высокой плотности, медь является хорошим проводником тепла и электричества.
Температура плавления меди составляет около 1083 градусов Цельсия. Это относительно низкая температура плавления, поэтому медь обладает отличной ковкостью и способностью принимать различные формы. Высокая температура плавления позволяет использовать медь во многих областях, где требуется высокая теплостойкость.
Щелочные металлы, такие как литий, натрий и калий, обладают намного более низкой температурой плавления, чем медь. Например, литий плавится при температуре около 180 градусов Цельсия, натрий при около 98 градусах Цельсия, а калий при примерно 63 градусах Цельсия. Это делает щелочные металлы более подходящими для использования в приложениях, где требуется низкая температура плавления, таких как аккумуляторы или сплавы.
Теплопроводность и электропроводность

Медь – щелочной металл с отличными теплопроводными и электропроводными свойствами. Ее высокая теплопроводность делает ее идеальным материалом для использования в различных теплообменных системах, например, в системах отопления и охлаждения.
Также, из-за своей высокой электропроводности, медь широко применяется в электротехнике и электронике. Она используется для производства проводов, кабелей и различных электрических компонентов. Благодаря своим электрическим свойствам, медные провода обладают низким электрическим сопротивлением и могут передавать большие объемы энергии без потерь.
Теплопроводность и электропроводность меди зависят от ее структуры и чистоты. Чем выше чистота меди, тем лучше ее тепло- и электропроводность. Кристаллическая структура меди позволяет электронам быстро перемещаться, что обеспечивает высокую электропроводность. Кроме того, медь обладает хорошей прочностью и устойчивостью к коррозии, что делает ее еще более привлекательной для использования в различных отраслях.
В целом, теплопроводность и электропроводность меди делают ее незаменимым материалом для различных технических и промышленных приложений. Благодаря своим уникальным свойствам, медь способна эффективно передавать тепло и электрическую энергию, что делает ее незаменимым материалом во многих отраслях промышленности и науки.
Химические свойства

Медь характеризуется высокой реакционностью и обладает широким спектром химических свойств. Одним из основных свойств меди является ее реакционность с кислородом. При взаимодействии с воздухом медь окисляется, образуя покрытие из меди(II) оксида, которое имеет темно-коричневый цвет.
Медь также активно взаимодействует с хлором, бромом и йодом, образуя соответствующие хлориды, бромиды и йодиды. Эти соединения обладают высокой стабильностью и используются в различных сферах, таких как производство пластиков, лаков, красителей и фотопленок.
Другим важным свойством меди является ее способность реагировать с кислотами. Кислотное растворение меди приводит к образованию солей меди, которые имеют различные применения, включая использование в производстве электроники, аккумуляторов и антибактериальных покрытий.
Кроме того, медь проявляет свойства амфотерного оксида, то есть может действовать как основание и кислота. Это свойство позволяет ей взаимодействовать с различными веществами и использоваться в качестве катализатора в химических процессах.
Таким образом, химические свойства меди обусловлены ее высокой реакционностью и способностью образовывать стабильные соединения с различными элементами и соединениями.
Реакция меди с воздухом и водой

Медь является химическим элементом с атомным номером 29 и химическим символом Cu (от латинского cuprum). Она обладает высокой электропроводностью и отлично справляется с передачей электрического тока. Кроме того, медь сама является активным элементом и может проявлять химическую реакцию при взаимодействии с различными веществами.
При контакте меди с воздухом происходит окисление металла. На поверхности меди образуется патина, состоящая из основного оксида меди (Cu2O) и сложного оксида меди (CuO). Патина имеет характерный зеленоватый цвет и обладает защитными свойствами, препятствуя дальнейшему окислению металла. Именно поэтому медь широко используется в качестве кровельного материала и для изготовления декоративных изделий.
Медь обладает способностью взаимодействовать с водой. При длительном погружении меди в воду, особенно при наличии растворенных кислотных или щелочных соединений, может происходить растворение металла с образованием ионов меди. Также медь может образовывать соли с различными кислотами, например, с соляной кислотой образуется хлорид меди (CuCl2).
В результате реакции меди с водой и воздухом образуются различные соединения, которые имеют свои химические и физические свойства. Процессы окисления и растворения меди важны для понимания механизмов ее образования и взаимодействия с другими веществами. Использование меди в различных областях промышленности и науки невозможно без учета ее реакционной способности.
Медь как катализатор

Медь широко используется в промышленности в качестве катализатора. Катализатор – это вещество, которое изменяет скорость химической реакции, участвуя в ней, но не расходуясь при этом. Как катализатор, медь обладает рядом уникальных свойств, которые делают ее незаменимой в различных процессах.
Во-первых, медь обладает высокой активностью в ряде важных химических реакций. Она способна активировать молекулы, ускорять их взаимодействие и снижать энергию активации реакций. Благодаря этим свойствам медь используется в процессах окисления-восстановления, полимеризации, гидрирования и других реакциях, где требуется высокая активность катализатора.
Во-вторых, медь обладает химической стабильностью. Она не подвергается инородным реакциям и не окисляется воздухом при комнатной температуре. Такое свойство делает медь долговечным и эффективным катализатором, который может использоваться в условиях высоких температур и влажности.
Кроме того, медь обладает высокой поверхностной активностью. Ее поверхность обладает большим количеством активных центров, что позволяет ей вступать во взаимодействие с другими молекулами и способствовать протеканию реакций. Благодаря этому свойству, медь используется в катализе реакций гидрогенации, фиксации азота, синтеза аммиака и других важных процессах.
Все эти особенности делают медь незаменимым катализатором в промышленности. Она обладает высокой активностью, химической стабильностью и поверхностной активностью, что позволяет ей участвовать в различных химических реакциях и повышать их эффективность и скорость. Благодаря этим свойствам, медь находит применение в различных отраслях промышленности, от нефтепереработки до производства катализаторов для чистки выбросов.
Классификация щелочных металлов
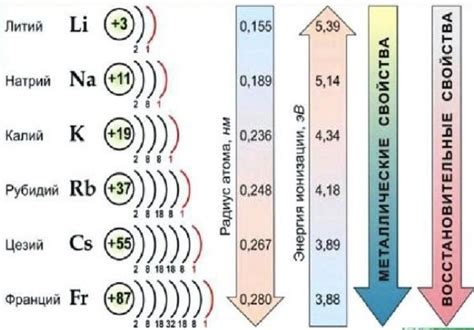
Щелочные металлы – это группа элементов, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы относятся к первой группе периодической системы, также известной как Группа 1А. Их атомы имеют один электрон в своей внешней оболочке, что делает их очень реактивными и легко окисляемыми.
Щелочные металлы обладают следующими общими химическими свойствами:
- Высокая активность – они реагируют с водой, кислородом и другими веществами;
- Образуют ион положительного заряда – катионы;
- Образуют ионные соединения с анионами, обеспечивая стабильность и электронную нейтральность;
- Имеют низкую плотность, низкую температуру плавления и высокую теплопроводность.
Щелочные металлы также имеют различные применения в промышленности, науке и повседневной жизни, включая использование в батареях, производстве стекла, создании лекарственных препаратов и т.д. Каждый из этих элементов имеет свои уникальные химические и физические свойства, что делает их полезными в различных сферах.
Вопрос-ответ

Какие свойства меди можно выделить?
У меди есть такие свойства, как высокая теплопроводность, электропроводность и пластичность. Она также обладает антибактериальными свойствами и хорошо устойчива к коррозии.
Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются низкой плотностью, реактивностью и хорошей электропроводностью.
Какие особенности присущи щелочным металлам?
Особенности щелочных металлов: низкая плотность, низкая температура плавления, высокая реактивность (тенденция к активной реакции с водой и кислородом), высокая электропроводность и теплопроводность, химическая инертность в нахождении в воздухе.
