Степень окисления металлов - это одна из важнейших характеристик химических элементов. Она указывает на число электронов, которые металл может отдать или принять при образовании химических соединений. Степень окисления непосредственно связана с номером группы, в которой находится металл в периодической системе.
Периодическая система Д.И.Менделеева разделена на несколько групп, каждая из которых имеет свои особенности. Степень окисления металлов зарезервирована главным образом для элементов переходных групп, а также для элементов главной подгруппы. В группах 1 и 2 элементы имеют валентность, равную номеру группы. В группе 3 валентность равна номеру группы минус два. В группе 4 валентность равна нулю. В группах 5, 6, 7 и 8 валентность равна номеру группы минус восемь. В группе 9 валентность равна номеру группы минус семь. Главными образом, определяется валентность окисления элементов в группах 10 и 11.
Ориентируясь на номер группы, можно оценить степень окисления металлов и их химическую активность. Это важное знание позволяет предсказать свойства веществ, их поведение в реакциях и образование стабильных химических соединений.
Степень окисления металлов и ее значение

Степень окисления металлов – это числовая характеристика, отражающая электрический заряд, наделенный атомом металла при образовании соединения. Она определяет электрохимическую активность металла и его способность вступать в химические реакции. Степень окисления металла может принимать положительное, отрицательное или нулевое значение в зависимости от положения металла в периодической системы.
Степень окисления металлов тесно связана с номером группы, в которой находится металл в периодической системе. Чем ниже номер группы, тем ниже степень окисления. Например, у металлов I группы степень окисления всегда равна +1, а у металлов II группы – +2. Это связано с тем, что металлы I группы имеют один свободный электрон в внешней энергетической оболочке, а металлы II группы – два свободных электрона.
Степень окисления металлов имеет важное значение при проведении химических реакций и составлении химических формул соединений. Она позволяет определить количество электронов, которые металл отдает или принимает при образовании соединения.
Знание степени окисления металлов позволяет более точно определить их химические свойства и способствует пониманию причин возникновения различных типов реакций. Также она является основой для построения электрохимических рядов и определения окислительно-восстановительного потенциала металлов.
Понятие о номере группы в таблице Менделеева
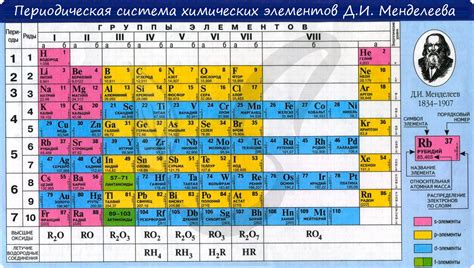
Таблица Менделеева является одним из главных инструментов в изучении химии. В ней элементы упорядочены по возрастанию атомного номера, а также разделены на группы и периоды. Номер группы отражает особенности химических свойств элементов, позволяя сделать выводы о строении и поведении веществ.
Номер группы определяется количеством электронов во внешней оболочке атома. Это позволяет говорить о валентности элементов в данной группе: семейства элементов с одинаковым номером группы имеют аналогичное количество электронов на внешней оболочке и, следовательно, сходные свойства.
Наиболее характерные свойства элементов в группе определяются силой взаимодействия валентных электронов с ядром атома. Чем выше номер группы, тем слабее это взаимодействие, что влечет за собой увеличение активности элемента. Например, в первой группе находятся щелочные металлы, которые обладают высокой реактивностью из-за того, что у них всего один валентный электрон.
Однако имеются и исключения из этого правила. Например, элементы из группы переходных металлов имеют разное количество валентных электронов и проявляют различные свойства. Также в группе галогенов и углерода можно наблюдать отклонения от общей закономерности.
Связь между степенью окисления металлов и номером группы

Степень окисления металлов определяется числовым значением, которое показывает, сколько электронов металл способен отдать или принять при образовании соединений. В свою очередь, номер группы, в которой находится металл в периодической системе, указывает на количество электронов в его внешней электронной оболочке. Таким образом, между степенью окисления металлов и номером группы существует тесная связь.
Чем выше номер группы, тем больше электронов имеет металл в своей внешней оболочке. Соответственно, такой металл может отдавать электроны с меньшими усилиями и образовывать соединения с более низкой степенью окисления. Например, металлы из первой группы (литий, натрий, калий) имеют степень окисления +1. Вторая группа (магний, кальций, стронций) имеет степень окисления +2. Таким образом, можно видеть закономерность: степень окисления металлов увеличивается с увеличением номера группы.
В случае переходных металлов, степень окисления может быть различной и зависит от конкретного соединения. Это связано с возможностью перехода электронов между разными энергетическими уровнями внутри атома. Например, железо может иметь степень окисления +2 и +3 в различных соединениях.
Однако, не всегда степень окисления металла совпадает с его номером группы. Иногда металлы могут образовывать соединения с отрицательной степенью окисления, что связано с возможностью получения электронов от других атомов или ионов. Например, некоторые металлы из группы 6 (хром, молибден) могут иметь степень окисления -2.
Таким образом, связь между степенью окисления металлов и номером группы является общей закономерностью, хотя существуют и исключения в виде переходных металлов и атомов с возможностью получения электронов.
Примеры металлов с разными степенями окисления
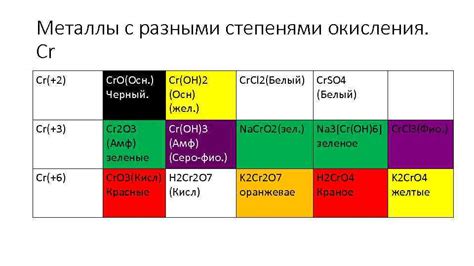
Степень окисления металла определяет количество электронов, которые он может отдать или принять при образовании соединений. Таким образом, разные металлы могут иметь разные степени окисления.
Некоторые металлы имеют только одну степень окисления, например, щелочные металлы, такие как натрий (Na) и калий (K), которые всегда имеют степень окисления +1. Это связано с тем, что эти металлы имеют только один электрон во внешней оболочке.
Другие металлы могут иметь несколько степеней окисления, в зависимости от условий реакции. Например, железо (Fe) может иметь степени окисления +2 и +3. В соединениях с легкими кислотами, такими как соляная кислота, железо имеет степень окисления +2, а в соединениях с сильными кислотами, такими как серная кислота, степень окисления железа равна +3.
Алюминий (Al) также имеет несколько степеней окисления, включая +3 и +1. В соединениях с кислородом, алюминий имеет степень окисления +3, а в некоторых соединениях с гидроксидами, такими как гидроксид алюминия (Al(OH)3), степень окисления алюминия равна +1.
Таблица ниже показывает несколько примеров металлов с разными степенями окисления:
| Металл | Степень окисления |
|---|---|
| Железо (Fe) | +2, +3 |
| Алюминий (Al) | +3, +1 |
| Марганец (Mn) | +2, +4, +7 |
| Медь (Cu) | +1, +2 |
Это лишь некоторые примеры металлов с разными степенями окисления. Многие другие металлы также могут иметь несколько степеней окисления в различных соединениях.
Роль степени окисления в свойствах и реактивности металлов

Степень окисления металлов играет важную роль в их свойствах и реактивности. Степень окисления определяет число электронов, которые атом металла принял или отдал в химической реакции. Это влияет на возможность формирования ионов, образование соединений и изменение свойств металлов.
Высокая степень окисления металлов указывает на то, что атом металла отдал много электронов. Металлы с высокой степенью окисления обычно образуют положительные ионы и могут быть более реактивными. Это связано с тем, что высокая энергия движения электронов делает эти металлы более склонными к химическим реакциям и образованию соединений с другими элементами.
Низкая степень окисления металлов, наоборот, указывает на то, что атом металла принял мало электронов. Металлы с низкой степенью окисления часто образуют отрицательные ионы и могут проявлять менее выраженную реактивность. Например, металлы с низкой степенью окисления могут быть устойчивыми к окислению и температуре.
Степень окисления металлов имеет также значение для формирования соединений и определения типа химической связи. Металлы с разными степенями окисления могут образовывать различные соединения, в которых металл может иметь разную зарядность. Это позволяет металлам образовывать различные типы химической связи и обладать различными физическими и химическими свойствами. Например, различные степени окисления железа приводят к образованию разных соединений, таких как Fe2O3 и Fe3O4, с разными физическими и магнитными свойствами.
Таким образом, степень окисления металлов играет важную роль в их свойствах и реактивности. Она определяет возможность формирования ионов, образование соединений и изменение свойств металлов. Различная степень окисления металлов позволяет им образовывать разные соединения и обладать различными физическими и химическими свойствами. Это делает степень окисления одним из ключевых параметров для изучения металлов и их реакций с другими веществами.
Изменение степени окисления при образовании ионов

Степень окисления, также называемая окислительным состоянием, является важной характеристикой атома или иона металла. При образовании ионов металлы обычно теряют электроны, что приводит к изменению их степени окисления.
При переходе металлов из нейтрального состояния в ионы, они обычно теряют электроны, приобретая положительную степень окисления. Например, натрий (Na), находящийся во II группе периодической таблицы, при образовании иона Na+ теряет один электрон, изменяя свою степень окисления с 0 до +1.
В некоторых случаях, одна и та же металлическая частица может образовывать ионы с различными степенями окисления. Например, железо (Fe) может образовывать ионы Fe2+ и Fe3+, при этом меняя свою степень окисления с +2 до +3. Это связано с изменением количества потерянных электронов.
Степень окисления металлов связана с номером их группы в периодической таблице. Металлы в группах I и II обычно имеют положительную степень окисления, соответствующую номеру группы. Например, все металлы группы I (кроме водорода) будут иметь степень окисления +1, а металлы группы II - +2.
Изменение степени окисления металлов при образовании ионов имеет важное значение в химических реакциях, поскольку позволяет определить типы связей, в которых участвуют металлы и ионы. Знание степени окисления металлов позволяет легче понять и предсказать их химическое поведение и взаимодействие с другими веществами.
Вопрос-ответ

Как связана степень окисления металлов с номером группы?
Степень окисления металлов обычно увеличивается с увеличением номера группы. Это связано с тем, что в химических реакциях металлы чаще всего отдают электроны, образуя положительные ионы. Чем выше номер группы, тем больше электронов у металла, доступных для отдачи, и, следовательно, выше его степень окисления.
Почему степень окисления металлов увеличивается с увеличением номера группы?
Степень окисления металлов увеличивается с увеличением номера группы, потому что при взаимодействии с другими веществами металлы обычно отдают электроны и образуют положительные ионы. Чем больше электронов у металла, доступных для отдачи, тем выше его степень окисления. Поэтому металлы в старших группах имеют более высокую степень окисления, чем металлы в младших группах.
