Степень окисления металлов - это значение, которое указывает, сколько электронов металл может получить или отдать при образовании соединений. Это показатель важен для понимания свойств и химической активности металлов, так как он определяет их способность реагировать с другими веществами. В этой статье мы рассмотрим полный список максимальных степеней окисления различных металлов.
Степени окисления металлов могут быть положительными или отрицательными. Положительная степень окисления указывает на способность металла отдать электроны при реакции, в то время как отрицательная степень окисления указывает на его способность принять электроны. Чем выше значение степени окисления, тем больше электронов металл может выделять или принимать.
В таблице ниже представлен полный список максимальных степеней окисления различных металлов:
Металл Максимальная степень окисления
Алюминий 3
Железо 3
Медь 2
Серебро 1
Золото 1
...
Это лишь небольшая часть всего списка максимальных степеней окисления металлов. Полный список содержит большое количество металлов и их значений. Знание этих значений позволяет понять, какие соединения металлов можно образовать и как металл будет вести себя в химических реакциях. Таким образом, список максимальных степеней окисления металлов является важным сведением для всех, кто интересуется химией и свойствами металлов.
Все степени окисления металлов в таблице периодических элементов

Степень окисления металлов в таблице периодических элементов - это число, которое указывает, сколько электронов металл может отдать или принять при формировании ионов. Она определяется главным образом на основе положения элемента в таблице и его электронной конфигурации.
Подавляющее большинство металлов имеют несколько возможных степеней окисления. Некоторые металлы могут образовывать ионы с разными степенями окисления, в зависимости от условий реакции. Набор возможных степеней окисления металла может изменяться в зависимости от соединения или окружающих условий.
В таблице периодических элементов можно увидеть возможные степени окисления для каждого металла. Некоторые из самых распространенных степеней окисления для металлов включают +1, +2, +3, +4, +5 и +6. К примеру, железо может иметь степень окисления +2 и +3, а марганец - +2, +3 и +4.
Важно помнить, что возможные степени окисления металла - это всего лишь общие тренды, и в конкретных соединениях эти значения могут отличаться. Также степень окисления может меняться в результате химических реакций и внешних условий.
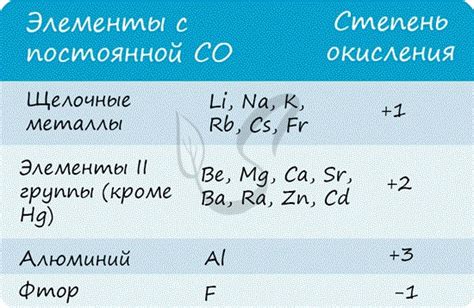
Степень окисления +1

В химии степень окисления обозначает число, которое указывает, сколько электронов передвинул атом данного элемента при образовании соединения. Существуют различные степени окисления металлов, включая степень окисления +1.
Некоторые металлы имеют способность образовывать соединения с положительной степенью окисления +1. К таким металлам относятся литий (Li), натрий (Na), калий (K) и серебро (Ag), а также несколько других элементов.
Металлы с положительной степенью окисления +1, как правило, образуют ионы с одним положительным зарядом. Это связано с тем, что они имеют всего один электрон в своей внешней электронной оболочке, который они готовы отдать с целью образования более устойчивого соединения.
Примером соединения, в котором металл имеет степень окисления +1, является гидроксид натрия (NaOH). В этом соединении натрий отдаёт свой один электрон кислороду и в результате образуется ион Na+ с положительным зарядом.
Таким образом, степень окисления +1 играет важную роль в химии металлов и помогает определить их способность образовывать различные соединения.
Степень окисления +2

В химии степень окисления (окислительное число) отражает изменение электронного состояния атома в процессе окисления или восстановления. Максимальная степень окисления металлов часто определяется их электронной конфигурацией и связями с другими элементами.
К некоторым металлам относятся элементы, которые способны образовывать ионы с окислительным числом +2. Среди таких металлов можно выделить:
- Железо (Fe): железо в двухвалентном состоянии образует ионы Fe2+.
- Магний (Mg): магний практически всегда имеет окислительное число +2 и образует ионы Mg2+.
- Цинк (Zn): цинк образует ионы Zn2+ и является одним из наиболее стабильных соединений с окислительным числом +2.
- Марганец (Mn): марганец образует ионы Mn2+ и характерен своей способностью к изменению своей степени окисления.
Данные металлы с окислительным числом +2 имеют широкое применение в различных областях, начиная от металлургии и производства стали, до фармацевтики и сельского хозяйства.
Степень окисления +3

Степень окисления +3 — это одна из наиболее распространенных степеней окисления металлов. Она характеризуется наличием у металла трех свободных или связанных электронов в его внешней оболочке.
Металлы со степенью окисления +3 обнаруживаются в различных соединениях и соответствуют наиболее стабильному состоянию данных элементов. Они обладают высокой химической активностью, что связано с наличием трех электронов, которые они могут отдать при взаимодействии с другими веществами.
Некоторые примеры металлов со степенью окисления +3 включают: алюминий (Al), хром (Cr), железо (Fe), гафний (Hf), иттрий (Y), радий (Ra) и др.
Металлы с такой степенью окисления широко применяются в различных областях, в том числе в промышленности, электронике, производстве легких сплавов и т.д. Эти элементы обладают ценными физическими и химическими свойствами, что делает их неотъемлемой частью современной науки и технологий.
Общая характеристика металлов со степенью окисления +3 позволяет понять их роль в химических реакциях, свойства и применение. Каждый из этих элементов имеет свои особенности и специфические свойства, которые делают их уникальными и незаменимыми в определенных сферах деятельности.
Степень окисления +4

Степень окисления +4 характерна для многих металлов и является одной из наиболее распространенных степеней окисления. Данный уровень окисления указывает на то, что металл в соединении отдал четыре электрона.
Одним из металлов, которые могут иметь степень окисления +4, является титан. В соединениях с кислородом титан образует оксид TiO2, который широко используется в промышленности. Титановые оксиды обладают высокой устойчивостью и применяются в производстве красителей, электроники и солнечных батарей.
Другим металлом со степенью окисления +4 является цирконий. Он образует оксид ZrO2, который применяется в качестве катализатора, в производстве керамики, а также как добавка в стекло, улучшающая его механические свойства.
Кроме того, некоторые активные металлы, такие как свинец и уран, также могут образовывать соединения со степенью окисления +4. Например, уран образует оксид UO2, который используется в производстве ядерного топлива и является важным компонентом ядерной энергетики.
Таким образом, степень окисления +4 широко представлена в химических соединениях различных металлов и имеет значительное промышленное применение.
Степень окисления +5

Степень окисления +5 - это одна из наивысших степеней окисления для различных металлов. Она указывает на то, что металл потерял пять электронов, что делает его крайне нестабильным и склонным к реакциям с другими веществами.
В таблице Максимальной степени окисления металлов, некоторые из металлов, которые могут иметь степень окисления +5, включают металлы из группы платины, такие как платина (Pt), иридий (Ir) и рений (Re). Эти металлы имеют высокую степень окисления +5, что делает их полезными в различных химических процессах.
Степень окисления +5 также может быть характерна для некоторых переходных металлов, таких как ванадий (V) и антимон (Sb). В этих случаях степень окисления +5 указывает на то, что металл потерял пять электронов и достиг высокой электронной нестабильности.
Важно отметить, что степень окисления +5 не является самой высокой степенью окисления для всех металлов. Некоторые металлы, такие как осмий (Os) и рутений (Ru), могут иметь степень окисления +8 или даже выше. Однако степень окисления +5 все же считается достаточно высокой и важной в химических реакциях и процессах.
Список металлов с максимальной степенью окисления +6:
1. Марганец (Mn) - степень окисления +6 в соединении с кислородом образует перманганаты, такие как K2MnO4 и KMnO4.
2. Рений (Re) - соединения рения с кислородом могут иметь степень окисления +6, например, рениева кислота (HReO4).
3. Хром (Cr) - при образовании оксидов и пероксидов хром может иметь степень окисления +6. Например, хром(VI) оксид (CrO3) и хром(VI) пероксид (CrO5).
4. Ураний (U) - соединения урана с кислородом могут иметь степень окисления +6, например, уранаты (UO42-) и перуранаты (UO2(O2)2(2-)).
5. Осмий (Os) - в соединениях с кислородом осмий может иметь степень окисления +6, например, осмиева кислота (H2OsO4).
6. Селен (Se) - в некоторых селенидных соединениях, при образовании оксидов и пероксидов селена, он может иметь степень окисления +6. Например, перселеновая кислота (H2SeO4).
7. Теллур (Te) - в некоторых теллуровых соединениях, а также оксидах и пероксидах теллура он может иметь степень окисления +6. Например, теллуриевая кислота (H2TeO4).
8. Дубний (Db) - самый стабильный изотоп дубния имеет степень окисления +6. Этот элемент был синтезирован искусственно в лаборатории и изучается в качестве трансуранового элемента.
9. Хасиум (Hs) - самый стабильный изотоп хасия также имеет степень окисления +6. Хасий - это искусственный элемент, созданный исключительно в лабораторных условиях.
10. Межметаллические соединения - в некоторых соединениях, содержащих два металла, один из них может иметь степень окисления +6. Например, в пероксиде рений-осмия (ReOsO4) марганец имеет степень окисления +6.
Другие степени окисления

В случае металлов может существовать не только одна максимальная степень окисления, но и другие степени окисления, которые могут образовываться в различных условиях. Эти степени окисления могут иметь как положительное, так и отрицательное значение.
Например, у меди (Cu) помимо наиболее распространенной степени окисления +2 существует также степень окисления +1. Это может быть особенно полезно при рассмотрении различных реакций, где медь может менять свою степень окисления и таким образом участвовать в различных химических процессах.
У железа (Fe) существуют несколько степеней окисления, таких как +2, +3 и даже +6. Это связано с тем, что железо может образовывать различные соединения и вступать в различные химические реакции, благодаря чему оно является одним из самых полезных и широко используемых металлов.
Также можно отметить, что степени окисления металлов могут изменяться в зависимости от окружающей среды и условий реакции. Это значит, что один и тот же металл может иметь различные степени окисления в разных ситуациях.
Вопрос-ответ

Какие металлы имеют максимальную степень окисления?
Многие металлы имеют максимальную степень окисления. Некоторые из них включают ртуть, серебро и золото.
Какова максимальная степень окисления ртути?
Максимальная степень окисления ртути равна +2. Она может образовывать соединения, в которых ртуть находится в ионной форме Hg2+.
Какова максимальная степень окисления серебра?
Максимальная степень окисления серебра равна +1. Серебро может образовывать соединения, в которых присутствует Ag+ ионы.
Какова максимальная степень окисления золота?
Максимальная степень окисления золота равна +3. Золото может образовывать соединения, в которых присутствуют Au3+ ионы.
