Щелочные металлы являются одной из самых важных групп элементов в химии. В этой группе находятся элементы, которые характеризуются своей мягкостью, низкой плотностью и низкой температурой плавления. Самым легким щелочным металлом является литий.
Литий - это элемент с атомным номером 3 и символом Li в периодической таблице. Он является одним из самых легких элементов, имеющих многочисленные применения в различных отраслях науки и промышленности. Литий обладает высокой химической реактивностью и широко используется в производстве литиевых батарей, керамики, стекла и синтеза органических соединений.
Литий также обладает рядом уникальных свойств, которые делают его особенно интересным для исследований и применения. Он является самым легким металлом и обладает очень низкой плотностью. Кроме того, литий обладает высокой электропроводностью и теплопроводностью. Он также обладает высокой аффинностью к кислороду и реагирует с водой, образуя гидроксид лития и выделяя водород.
Литий имеет большое значение в современной науке и технологии. Его использование в литиевых батареях делает их одними из самых эффективных и долговечных источников энергии. Благодаря своей легкостью и высокой электропроводности, литий является основным материалом для создания легких и мощных аккумуляторов для мобильных устройств, электромобилей и других устройств.
Что такое щелочные металлы?
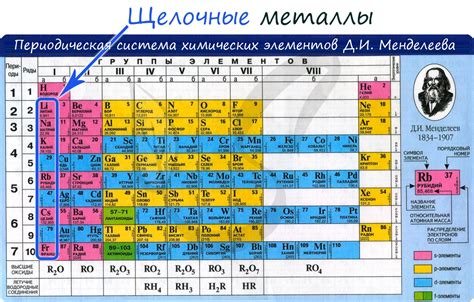
Щелочные металлы - это группа элементов, которые находятся в первой группе периодической системы и обладают рядом общих химических свойств. Эта группа включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы являются металлами с низкой плотностью, мягкостью и низкой температурой плавления. Они обладают отличной электропроводностью и реактивностью, что делает их полезными во многих различных промышленных процессах и технологиях.
Щелочные металлы активно взаимодействуют с водой, образуя щелочные растворы, газы и твёрдые вещества. Эта реакция является характеристикой щелочных металлов и играет важную роль в их использовании. Например, калий и натрий широко используются в сельском хозяйстве для удобрений, а литий применяется в аккумуляторах, лекарствах и электронике.
- Литий (Li) - легкий и реактивный элемент, активно используется в производстве лекарств, стекла, аккумуляторов и других электронных компонентов.
- Натрий (Na) - распространенный элемент, находится в соли, соде, пищевых продуктах. Широко используется в пищевой промышленности и в процессе приготовления пищи.
- Калий (K) - необходимый элемент для растений и животных, используется в сельском хозяйстве в качестве удобрения и в производстве стекла и мыла.
- Рубидий (Rb) - мягкий металл, применяется в производстве электронных приборов, а также в научных исследованиях и ядерной энергетике.
- Цезий (Cs) - находит применение в электротехнике, но наиболее известен как источник энергии в атомных часах и лазерных устройствах.
- Франций (Fr) - крайне редкий и радиоактивный элемент, его изучение ограничено его высокой нестабильностью и коротким полупериодом распада.
Почему самый легкий?

Самым легким щелочным металлом известен литий. Обладая атомным номером 3 и атомной массой около 6.94 г/моль, этот элемент является наименьшим и самым легким металлом в периодической системе. Литий обладает малой плотностью и мягкостью, что делает его особенно полезным в различных применениях.
Литий также обладает низкой температурой плавления и высокой реактивностью. Он входит в группу алкалийных металлов, которые хорошо растворяются в воде и образуют щелочные растворы. Благодаря этим свойствам литий широко используется в батареях, взрывчатых веществах, лекарствах и других сферах науки и промышленности.
Литий также обладает низкой плотностью, что делает его отличным материалом для изготовления лёгких конструкций, например, авиационных корпусов и космических аппаратов. Благодаря своей низкой плотности, литий является идеальным материалом для использования в легких и энергоэффективных батареях, которые нашли широкое применение в электронике и электромобилях.
Литий

Литий - самый легкий щелочной металл из всех известных химических элементов. Его атомный номер 3, а атомная масса около 6,94. Литий находится в первой группе периодической таблицы элементов и обладает атомным радиусом около 152 пикометров. Он является мягким и низкоплавким металлом с серебристо-белой окраской.
В природе литий обычно встречается в виде минерала или соединений с другими элементами. Известные особо богатые источники лития включают в себя соленые озера и подземные скважины. Литий также можно получить из солей, таких как литиевые карбонаты и литиевые хлориды.
Литий обладает несколькими уникальными свойствами, которые делают его важным элементом в различных областях. Одно из наиболее известных свойств лития - его способность быть использованным в литиевых аккумуляторах. Литиевые аккумуляторы обладают высокой плотностью энергии, длительным сроком службы и малым весом, что делает их идеальными для использования в мобильных телефонах, ноутбуках и электромобилях.
Кроме того, литий широко применяется в легкой промышленности, в производстве стеклопластиков и в медицине. Он также используется в ядерной энергетике и в производстве алюминия. Литий является необычайно реактивным металлом, который может взаимодействовать с водой, воздухом и другими веществами. Это делает его одним из самых интересных и полезных элементов в химии и промышленности.
Основные свойства лития

1. Низкая плотность: Литий является самым легким металлом с атомным номером 3 в периодической системе элементов. Его плотность составляет всего 0,53 г/см³, что делает его одним из самых легких известных материалов.
2. Активность: Литий является очень активным металлом и реагирует с водой, выделяя газ водород и образуя гидроксид лития. Он также реагирует с кислородом воздуха, образуя оксид лития.
3. Низкая плавкость: При температуре всего 180 градусов Цельсия литий начинается плавиться, что делает его одним из самых низкоплавких металлов.
4. Нейтронная активность: Литий является хорошим поглотителем нейтронов. Это свойство делает его полезным в ядерной энергетике и при производстве термоядерной энергии.
5. Высокая электропроводность: Литий обладает высокой электропроводностью, что делает его полезным для использования в литиевых батареях, которые широко используются в современных электронных устройствах и электрических автомобилях.
Применение лития
Литий – один из самых лёгких щелочных металлов и обладает рядом примечательных свойств, что делает его очень востребованным в разных областях науки и промышленности.
1. Батареи. Одним из наиболее известных и широко распространенных применений лития является его использование в литий-ионных аккумуляторах. Литиевые батареи обладают высокой энергетической плотностью, долгим сроком службы и небольшим весом. Они используются во многих электронных устройствах, таких как мобильные телефоны, ноутбуки, планшеты и электромобили.
2. Лекарства. Литийшироко применяется в медицине для лечения различных психических расстройств, таких как биполярное аффективное расстройство и депрессия. Он помогает стабилизировать настроение и предотвращать рецидивы данных заболеваний.
3. Смазки. Литиевая смазка - один из наиболее популярных типов смазки, используемых в промышленности и автомобилях. Она хорошо смазывает и защищает поверхности, обладает высокой устойчивостью к высоким и низким температурам и имеет долгий срок службы.
4. Ядерная энергетика. Литий используется в ядерной энергетике как топливо для термоядерных реакторов. Он является одним из наиболее эффективных материалов для захвата нейтронов и генерации тепла.
5. Аэрокосмическая промышленность. Литий используется в аэрокосмической промышленности для создания легких и прочных сплавов. Он также используется в составе теплоносителей, которые помогают отводить тепло от космических аппаратов.
Применение лития в различных отраслях продолжает расширяться, и его значимость только растет.
Натрий

Натрий – один из самых распространенных химических элементов на Земле. Его символ Na происходит от латинского названия "natrium". Натрий входит в состав многих минералов и океанической воды.
Данный элемент относится к щелочным металлам. Щелочные металлы характеризуются ярким металлическим блеском и низкой плотностью. Одной из наиболее известных свойств натрия является его способность образовывать щелочные растворы с водой.
Натрий обладает ярко-желтым цветом и мягкостью, что позволяет его резать ножом. Он активно вступает в реакцию с водой, образуя гидроксид натрия и выделяя водород. Натрий также обладает высокой теплопроводностью и является важным компонентом в производстве стекла, мыла, пищевых добавок и других товаров.
Из-за своей активности, натрий хранится в аргоновом атмосфере или в жидкораничных соединениях. В природе он присутствует в виде гидроксида, карбоната и хлорида. Хлорид натрия, более известный как поваренная соль, является одной из самых распространенных соединений натрия. Натрий также является необходимым элементом для нормального функционирования организма человека, и его недостаток может привести к проблемам со здоровьем.
Основные свойства натрия

Натрий – первый элемент в группе щелочных металлов периодической системы химических элементов, обозначается символом Na и имеет атомный номер 11. Он один из наиболее распространенных химических элементов в земной коре, а также в морской воде.
Основное свойство натрия – его активность. Он является очень реактивным металлом и легко соединяется с другими элементами. Реактивность натрия обусловлена его внешней электронной конфигурацией, которая состоит из одного электрона в валентной оболочке.
Натрий обладает металлическим блеском и имеет серебристо-белый цвет. Он очень мягкий и может быть нарезан ножом. Металл намного меньше плотен, чем вода, поэтому плавает на поверхности стоячей воды.
Важным свойством натрия является его способность реагировать с водой. При контакте с водой происходит тренд взрыв из-за образования водорода, который образует гидроксид натрия и выделяет большое количество тепла. По этой причине, натрий должен храниться в специально закрытых контейнерах, чтобы избежать несчастных случаев.
Также следует отметить, что натрий является важным элементом для нашего организма. Он играет ключевую роль в поддержании водного и электролитного баланса в организме, а также в работе нервной и мышечной систем.
Применение натрия

Натрий — легкий щелочной металл, широко используемый в различных областях промышленности и научных исследований. Его уникальные химические и физические свойства делают его незаменимым во многих процессах и продуктах.
Применение натрия:
- В производстве мыла и моющих средств. Натрий гидроксид (щелочь) является основным компонентом при производстве этих продуктов, так как он хорошо растворяется в воде и обладает моющими свойствами.
- В производстве стекла. Натрий карбонат (сода) является основным компонентом стекла и стеклоизделий. Он понижает температуру плавления смеси и делает стекло прозрачным и прочным.
- В производстве алюминия. Натрий используется для очистки руды алюминия, что позволяет получить более высокое качество металла.
- В производстве кристаллов. Натрий является ключевым компонентом многих электронных кристаллов, таких как солевые светоэмиттеры и светоизлучающие диоды.
Кроме того, натрий также используется в пищевой промышленности как консервант и регулятор кислотности, в производстве батарей, фармацевтических препаратов и многих других отраслях. Благодаря своей широкой применимости, натрий играет важную роль в современном мире и является неотъемлемой частью нашей повседневной жизни.
Калий

Калий – необходимый микроэлемент для жизнедеятельности организмов и основной щелочной металл в пептидах, ДНК и РНК. Он является одним из самых легких щелочных металлов и находится в 4-й группе периодической таблицы.
Калий имеет атомный номер 19, относительную атомную массу 39,1, и его химический символ - K. Он присутствует во многих минералах, таких как сильвинит, карниаллит, и поливиниловый спирт. Калий также является важным элементом в почве и играет важную роль в питании растений.
Преимущества калия для здоровья человека включают важные функции участия в регуляции водного баланса, нормализацию работы сердечно-сосудистой системы и поддержание здоровой функции мышц и нервной системы.
Калий также является незаменимым элементом в процессе обмена веществ и регулирования кровяного давления. Ежедневное потребление калия рекомендуется для поддержания здоровья и предотвращения развития таких заболеваний, как артериальная гипертония, болезнь сердца и почек.
- Калий можно получить из таких продуктов, как бананы, картофель, шпинат, брокколи и молочные продукты.
- Важно помнить, что оптимальная дневная норма калия для взрослых составляет около 2000-3000 мг, и удовлетворение этой потребности поможет поддерживать здоровый образ жизни.
Основные свойства калия
1. Химические свойства. Калий - щелочной металл с атомным номером 19 в периодической системе элементов. Он имеет ярко-серый цвет и мягкую консистенцию, что делает его легким для обработки и использования. Калий имеет высокую химическую активность и реактивность, что подтверждается его сильным щелочным характером.
2. Физические свойства. У калия низкая плотность - всего 0,86 г/см³, что делает его наименьшим по плотности металлом. Калий имеет низкую температуру плавления (63,38°C) и кипения (759°C), что делает его жидким при относительно невысоких температурах. Калий является хорошим проводником тепла и электричества, что делает его полезным материалом в различных промышленных процессах.
3. Реакция с водой. Калий очень реактивен с водой и может самовозгораться при контакте с ней. Это свойство обусловлено его активностью и способностью образовывать гидроксид калия (щелочной раствор). Реакция калия с водой происходит следующим образом: К + Н2О → КОН + H₂. В ходе этой реакции выделяется большое количество тепла.
4. Важная роль в органике. Калий является одним из важнейших макроэлементов, необходимых для нормального роста и функционирования растений. Он является ключевым компонентом питательной среды и участвует в многих биохимических процессах, включая синтез белков, фотосинтез и регулирование осмотического давления. Также калий является важным элементом в организме человека и выполняет множество функций, включая поддержание нормального кровяного давления и функциональности мышц и нервной системы.
Вопрос-ответ

Что такое щелочные металлы?
Щелочными металлами называются элементы первой группы периодической таблицы, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются металлами, обладают высокой химической реактивностью и активностью, а также обладают аналогичными химическими свойствами.
Каков самый легкий щелочной металл?
Самым легким щелочным металлом является литий (Li). Его атомная масса составляет около 6,94 единицы, что делает его самым легким из щелочных металлов. Литий также имеет наименьшую плотность среди щелочных металлов и является очень реактивным элементом.
Для чего используются щелочные металлы?
Щелочные металлы используются во многих областях. Например, литий используется в производстве аккумуляторов для мобильных устройств и электромобилей, натрий используется в производстве стекла, а калий является важным элементом для здоровья человека и используется в пищевой промышленности. Рубидий используется в электронике, цезий – в атомных часах, а франций, самый редкий и радиоактивный из щелочных металлов, используется в научных исследованиях.
