Li2o или диоксид лития – это химическое вещество, состоящее из атомов лития и кислорода. Один из самых известных оксидов лития, Li2o имеет интересные свойства и лежит на пересечении двух классов веществ: металлов и неметаллов.
Литий, химический элемент, который находится в первой группе периодической системы, обычно является металлом. Металлический литий обладает низкой плотностью, является мягким и легким. Однако в сочетании с кислородом, литий претерпевает значительные изменения и образует неметаллический соединительный оксид – Li2o.
Диоксид лития обладает ковалентной структурой, в которой атомы лития и кислорода образуют межатомные связи, обмениваясь электронами. Такая структура делает Li2o неметаллическим соединением, а его химические, физические и электронные свойства могут быть аналогичны тем, которые обнаруживаются у других неметаллических оксидов.
Что такое Li2o и какова его природа?

Li2o – это химическое соединение, состоящее из двух атомов лития и одного атома кислорода. Оно является оксидом лития, который может быть получен путем реакции металлического лития с кислородом. Li2o обладает кристаллической структурой и является бесцветным или белым веществом.
Li2o является неметаллическим соединением. Оно не проводит ток и не обладает металлическим блеском. Кроме того, Li2o обладает высокой температурой плавления и кипения, что подтверждает его неметаллическую природу.
Однако, несмотря на то, что Li2o является неметаллом, литий, из которого оно состоит в виде иона Li+, является металлом. Литий - металл из группы щелочных металлов и обладает такими характерными металлическими свойствами как низкая плотность, хорошая электропроводность и термическая проводимость.
Важно отметить, что Li2o имеет широкое применение. Оно используется в производстве стекол и керамики, в электрохимических средствах хранения энергии, а также в производстве литиевых батарей, которые широко используются в мобильных устройствах и электромобилях.
Lithium oxide (Li2O) входит в число минералов и хранит много интересной информации
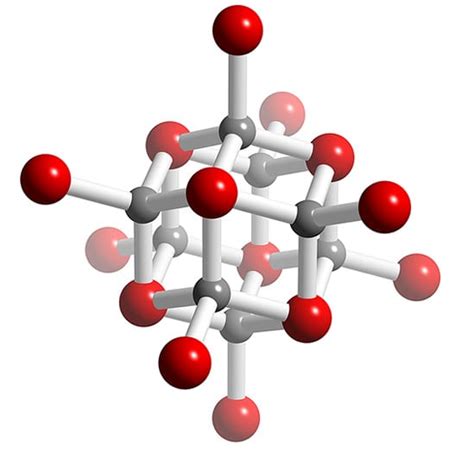
Lithium oxide (Li2O) – это соединение лития с кислородом, которое широко используется в различных областях науки и техники. Оно входит в число минералов и обладает рядом уникальных свойств, которые делают его интересным объектом изучения.
Одним из интересных фактов о lithium oxide (Li2O) является его способность образовывать кристаллическую структуру, которая обладает высокой стабильностью и прочностью. Благодаря этому, это соединение может быть применено в производстве керамики, электронных компонентов и других материалов, где требуется высокая термическая и механическая стойкость.
Еще одним интересным свойством lithium oxide (Li2O) является его способность растворяться в воде, образуя гидроксид лития (LiOH). Это делает его полезным в различных химических реакциях, а также в производстве аккумуляторов и фармацевтических препаратов.
Кроме того, lithium oxide (Li2O) является хорошим проводником электричества и может использоваться в производстве электродов для литий-ионных аккумуляторов. Благодаря своим электрохимическим свойствам, этот материал находит применение в современной энергетике и электронике.
Li2o: особенности периодической системы Д.И. Менделеева
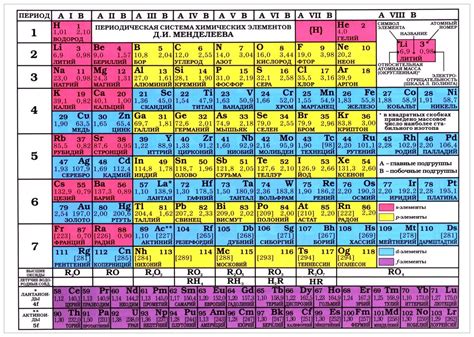
Периодическая система Д.И. Менделеева является систематическим упорядочением химических элементов. Она была создана в конце XIX века и стала одним из главных достижений русского химика и ученого.
Ключевой особенностью периодической системы Менделеева является то, что она позволяет классифицировать элементы по их свойствам и установить логический порядок их расположения. Система состоит из таблицы, где элементы расположены по возрастанию атомного номера.
Одной из главных особенностей периодической системы является семь главных горизонтальных строк, называемых периодами, и 18 вертикальных столбцов, называемых группами. В каждом периоде находится определенное количество элементов, а каждая группа содержит элементы с подобными химическими свойствами.
Li2o является химическим соединением, состоящим из элементов лития и кислорода. Литий относится к первой группе периодической системы, а кислород — к шестой группе. Такое соединение может быть представлено в виде формулы Li2o.
На основе периодической системы Менделеева можно сделать вывод, что Li2o не является отдельным элементом, а является химическим соединением, состоящим из элементов лития и кислорода.
Li2o: Химическое вещество, сильнее всего связанное с литием
Li2o (лидиев оксид) - химическое вещество, образованное из лития и кислорода. Это один из наиболее сильно связанных соединений лития, которое имеет множество важных применений в различных отраслях науки и промышленности.
Li2o обладает высокой степенью ионной связи, что делает его чрезвычайно стабильным и устойчивым соединением. Благодаря этим свойствам, Li2o используется в производстве литиевых аккумуляторов, которые являются основным источником питания для множества электронных устройств и автомобилей.
Кроме того, Li2o широко применяется в стекольной и керамической промышленности. Он используется в производстве специальных стекол, включая стекло с лучшей теплопроводностью и стекло для защиты от радиации. Также Li2o добавляют в керамические материалы для укрепления и повышения прочности, а также для улучшения их термических и электрических свойств.
Помимо этого, Li2o играет важную роль в ядерной энергетике. Он используется в процессе производства топлива для ядерных реакторов и обладает высокой способностью поглощать нейтроны, что делает его важным материалом для контроля ядерной реакции.
Таким образом, Li2o представляет собой химическое вещество, сильнее всего связанное с литием, и имеет широкий спектр применений в различных областях промышленности и науки.
Какие научно обоснованные утверждения можно сделать о природе Li2O?
1. Химический состав: Li2O состоит из двух атомов лития (Li) и одного атома кислорода (O). Соотношение атомов указывает на то, что Li2O является бинарным соединением.
2. Валентность элементов: Литий (Li) относится к первой группе периодической системы и имеет валентность +1, в то время как кислород (O) относится к шестой группе и имеет валентность -2. В результате соединения Li2O качественное соотношение зарядов должно быть удовлетворено.
3. Структура: Li2O образует кристаллическую решетку типа кубической гранецентрированной, в которой ионы лития окружены шестью ионами кислорода. Такая структура обуславливает свойства соединения и его устойчивость.
4. Физические свойства: Li2O является белым кристаллическим порошком, плохо растворимым в воде. Молекулярная масса Li2O равна 29,88 г/моль. Литийоксид обладает высокой температурой плавления (более 1200 °С) и высокой твердостью.
5. Химические свойства: Li2O реагирует с водой с образованием гидроксида лития (LiOH) и выделением тепла. Это гидроксид обладает щелочными свойствами и используется в производстве литиевых аккумуляторов и других промышленных процессах.
6. Применение: Li2O используется в качестве компонента в производстве стекла и керамики, а также как катализатор для некоторых химических реакций. Он также находит применение в области энергетики, особенно в производстве литиевых батарей и аккумуляторов.
Основные свойства Li2O и его значение для промышленности

Li2O (диоксид лития) представляет собой химическое соединение, состоящее из двух атомов лития и одного атома кислорода. Этот соединение обладает рядом важных свойств и находит широкое применение в промышленности.
Первоначально стоит отметить, что Li2O является неметаллом. Это соединение обладает высокой степенью растворимости в воде и образует щелочные растворы. Благодаря этим свойствам, диоксид лития активно используется в производстве стекла, в качестве щелочной добавки. Он способствует повышению плавкости стекла, устраняет взаимодействие с оксидами металлов и, таким образом, улучшает его качество.
Кроме того, Li2O применяется в полупроводниковой промышленности. Он является одним из основных компонентов для создания литиевых химических элементов, которые активно используются в производстве аккумуляторов, солнечных батарей и других электронных устройств. Это связано с тем, что литий обладает высокой электроотрицательностью и способен образовывать стабильные электролиты.
Однако, помимо полезных свойств, следует также отметить, что Li2O является высокотоксичным соединением. При взаимодействии с кожей или слизистыми оболочками оно может вызывать раздражение и ожоги. Поэтому, во время работы с этим веществом, необходимо соблюдать необходимые меры безопасности и работать с ним только в специальных условиях и с использованием защитного оборудования.
В целом, свойства Li2O делают его важным и неотъемлемым элементом в различных отраслях промышленности. Способность этого соединения повышать качество стекла и обладать полезными электрическими свойствами делает его необходимым компонентом для создания различных материалов и устройств, которые сегодня активно используются в современном мире.
Основные применения Li2O в области науки и техники
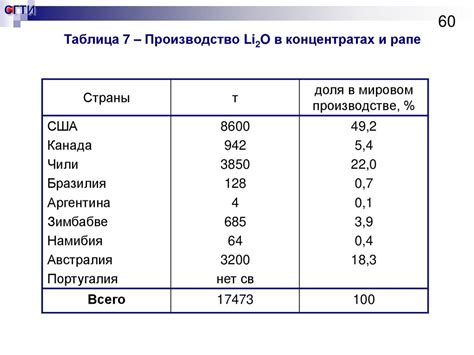
1. Силикатная индустрия:
Li2O широко используется в производстве различных видов стекла, керамики и силикатных материалов. Благодаря своим уникальным свойствам, Li2O повышает прочность и термическую стабильность таких материалов, делая их идеальными для использования в высокотемпературных приложениях, например, в производстве посуды и высокотемпературных облицовочных материалах.
2. Электрохимическая промышленность:
Li2O используется в производстве литий-ионных аккумуляторов, которые являются основой многих портативных электронных устройств, таких как мобильные телефоны, ноутбуки и планшеты. Благодаря способности лития реагировать с катодными материалами, Li2O обеспечивает высокую энергетическую плотность и длительное время работы аккумуляторов.
3. Ядерная энергетика:
Li2O играет важную роль в ядерной энергетике. С его помощью производят литийгидрат, который служит в качестве ослабителя нейтронов в реакторах на ядерном топливе. Li2O поглощает лишние нейтроны, помогая поддерживать стабильность реакции деления ядерного топлива.
4. Космическая промышленность:
Li2O применяется в производстве термоэлектрических материалов, которые могут преобразовывать тепловую энергию в электрическую для использования в космических аппаратах. Благодаря своим высоким термоэлектрическим свойствам, Li2O помогает увеличить эффективность работы электрических систем в условиях космического пространства.
5. Функциональные покрытия:
Li2O используется в производстве тонкопленочных материалов, которые наносятся на различные поверхности для придания им функциональных свойств, таких как прозрачность, гидрофобность или антикоррозийная защита. Покрытия на основе Li2O могут применяться в различных отраслях, включая электронику, оптику, автомобильную и строительную промышленность.
Вопрос-ответ

Ли2о — это металл или неметалл?
Li2O — это неорганическое вещество, которое является оксидом лития. Ответ на вопрос, является ли он металлом или неметаллом, зависит от выбранной системы классификации химических элементов. В обычной классификации химических элементов Литий относится к алкалийным металлам, а кислород — к неметаллам. Поэтому оксид лития, включающий литий и кислород, можно классифицировать как соединение металла и неметалла.
Что известно о химических и физических свойствах Li2o?
Li2O — это белый, кристаллический порошок, который практически нерастворим в воде. Он может растворяться в кислотах, образуя литиевые соли. Литиевый оксид имеет высокую температуру плавления и кипения. Он имеет явно щелочной характер, так как образует щелочную реакцию при растворении в воде. Это соединение является важным реагентом в различных химических процессах.
Каково применение Li2o в промышленности?
Li2O в промышленности находит широкое применение. Он используется в электрохимических батареях, особенно в литиевых ионных аккумуляторах. Он также используется в качестве катализатора для различных химических реакций. Благодаря своим щелочным свойствам Li2O применяется в стекольной промышленности для улучшения свойств стекла, таких как прозрачность и стойкость к кислотам.
Можно ли использовать Li2o в медицине?
Литиевый оксид (Li2O) не используется непосредственно в медицине. Однако литий-ионные соединения, такие как литиевые соли, используются в медицинской практике для лечения психических расстройств, таких как биполярное расстройство и депрессия. Литиевые соли позволяют стабилизировать настроение и уменьшать симптомы этих заболеваний. Но важно отметить, что использование литиевых ионов требует соблюдения определенных дозировок и контроля врача, так как неправильное использование может быть опасным для здоровья.
