Взаимодействие кислот с оксидами металлов - одна из основных тем, изучаемых в химии. Эта лабораторная работа позволяет студентам лучше понять процессы, происходящие при соединении кислоты и оксида металла. Это важно для понимания многих химических реакций и применения их в различных областях науки и промышленности.
На данном занятии студентам предлагается провести наблюдения и эксперименты, используя разные типы кислот и оксиды металлов. Они смешивают разные соединения и наблюдают, как это взаимодействие влияет на свойства и состав реагентов. Также студенты изучают различные способы измерения реакции, используя методы количественного анализа.
Эта лабораторная работа позволяет студентам развить навыки наблюдения, анализа и интерпретации результатов. Они учатся обозначать химические реакции, проводить исследования и делать выводы о том, какие вещества образуются после взаимодействия кислоты и оксида металла. В результате работы студенты углубляют свои знания о химических процессах и их практическом применении.
Роль оксидов металлов в химических реакциях

Оксиды металлов играют важную роль в химических реакциях. Они являются химическими соединениями, состоящими из кислорода и металла. Присутствие оксидов металлов в реакциях проявляется в их способности вступать во взаимодействие с кислотами.
Один из основных типов реакций, в которых участвуют оксиды металлов, - это реакции с кислотами. Во время таких реакций оксид металла вступает в реакцию с кислородом кислоты, образуя соль и воду. Например, при реакции оксида цинка (ZnO) и соляной кислоты (HCl) образуется соль цинка (ZnCl2) и вода (H2O).
В реакциях с кислотами оксиды металлов могут выступать в качестве оснований. Они способны принять протоны от кислоты и образовать соли. Такие реакции проявляют себя в образовании солей металлов и воды. Например, реакция оксида алюминия (Al2O3) с соляной кислотой приводит к образованию соли алюминия (AlCl3) и воды (H2O).
Оксиды металлов также могут служить катализаторами в химических реакциях. Катализ - это процесс, при котором вещество (каталитический агент) ускоряет химическую реакцию, не изменяясамо в процессе. Оксиды металлов могут быть использованы в качестве катализаторов для ускорения различных химических процессов.
Таким образом, оксиды металлов выполняют важную роль в химических реакциях. Они взаимодействуют с кислотами, образуя соли и воду, могут служить основаниями, участвуют в катализаторных процессах. Изучение роль оксидов металлов в различных химических реакциях является важным аспектом изучения химии и примененияых ее в промышленных и научных целях.
Свойства и классификация кислот
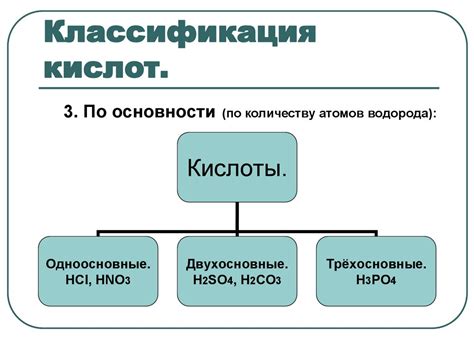
Кислоты — это один из классов химических соединений, которые обладают определёнными свойствами. Они образуются при образовании ковалентных связей между атомами водорода и атомами других элементов.
Кислоты могут свободно диссоциировать в растворах, образуя ион H+. Это свойство называется ацидностью. Кроме того, кислоты обладают коррозионной активностью по отношению к металлам и способны реагировать с оксидами металлов.
Классификация кислот основывается на различных признаках:
- По происхождению: некоторые кислоты могут быть органического происхождения, такие как уксусная кислота, ионы которой образуются при окислении этилового спирта.
- По состоянию: кислоты могут быть как жидкими, так и твёрдыми. Например, серная кислота, бензойная кислота и уксусная кислота широко используются в промышленности и находятся в жидком состоянии.
- По силе: кислоты могут быть сильными или слабыми в зависимости от степени диссоциации в растворе. Например, серная кислота является сильной кислотой, а уксусная кислота - слабой.
Классификация кислот помогает понять и изучать их свойства, а также выбрать подходящие методы и условия для их использования в химических реакциях и лабораторных исследованиях.
Определение кислотности оксидов металлов

Оксиды металлов представляют собой химические соединения, состоящие из кислорода и металлических элементов. Они обладают различной степенью кислотности, что определяется их способностью взаимодействовать с кислотами или основаниями.
Для определения кислотности оксидов металлов используются различные методы. Один из них – это реакция оксида металла с кислотой. В зависимости от степени кислотности, оксид металла может быть нейтральным, основным или кислым.
Нейтральные оксиды металлов обладают низкой кислотностью и не реагируют с кислотами или основаниями. Они имеют формулу МО, где М – металл. Примером нейтрального оксида является оксид железа (III) – Fe2O3.
Основные оксиды металлов реагируют с кислотами, образуя соли и воду. Они имеют формулу МОН, где М – металл. Примером основного оксида является оксид кальция – CaO.
Кислые оксиды металлов реагируют с основаниями, образуя соли и воду. Они имеют формулу М2Оn, где М – металл, n – степень окисления металла. Примером кислого оксида является оксид серы (IV) – SO2.
При определении кислотности оксидов металлов проводят реакции с известными кислотами или основаниями и анализируют продукты реакции. Таким образом, можно определить степень кислотности и классифицировать оксид металла.
Лабораторная работа по взаимодействию кислот с оксидами металлов

Целью данной лабораторной работы является изучение взаимодействия кислот с оксидами металлов и определение их химической активности. В ходе эксперимента мы будем исследовать реакции образования солей при объединении кислот и оксидов металлов.
Для проведения эксперимента мы выбрали несколько кислот и оксидов металлов, которые хорошо сочетаются с целью работы и обеспечивают разнообразие реакций. В процессе будет использоваться соляная кислота, а также оксиды меди, железа и алюминия.
Перед началом работы необходимо подготовить растворы кислот и оксидов металлов и провести их идентификацию. Для этого будут использоваться химические методы, такие как изменение цвета, появление осадка и другие признаки химических реакций.
В ходе эксперимента мы будем наблюдать, как кислоты реагируют с оксидами металлов, образуя соли и высвобождая газы. Результаты эксперимента помогут нам определить активность оксидов металлов и установить связь между химической активностью и положением металла в ряду активности.
Изучение взаимодействия кислот с оксидами металлов является важным шагом в изучении химии и позволяет понять принципы химических реакций и свойства веществ. Полученные результаты могут быть использованы для прогнозирования реакций и выбора оптимальных условий для синтеза различных соединений.
Анализ результатов и выводы
В ходе проведения лабораторной работы было изучено взаимодействие кислот с оксидами металлов. Были протестированы различные кислоты и оксиды металлов, а также получены результаты реакций.
В ходе эксперимента было установлено, что реакция кислоты с оксидом металла приводит к образованию соответствующей соли и воды. При этом наблюдался переход веществ в новые агрегатные состояния, что свидетельствует о реакции.
Было обнаружено, что различные кислоты и оксиды металлов имеют разные скорости реакции и интенсивность образования новых веществ. Это может быть связано с различием в активности кислот и оксидов металлов.
На основе полученных данных можно сделать вывод, что взаимодействие кислот с оксидами металлов является эндотермическим процессом, сопровождающимся выделением тепла. Также можно сделать предположение о том, что скорость реакции зависит от концентрации кислоты и оксида металла.
Вопрос-ответ

Какие кислоты взаимодействуют с оксидами металлов?
В качестве кислот могут использоваться различные соединения, например, соляная кислота (HCl), серная кислота (H2SO4), азотная кислота (HNO3) и др. Взаимодействие кислот с оксидами металлов зависит от их свойств и реакционной способности.
Какова цель лабораторной работы по химии, связанной с взаимодействием кислот с оксидами металлов?
Целью лабораторной работы является изучение химической реакции между кислотами и оксидами металлов, а также определение их характера и свойств. Это позволяет лучше понять принципы химических реакций и взаимодействия различных соединений.
Как проводится лабораторная работа по взаимодействию кислот с оксидами металлов?
Для проведения лабораторной работы необходимо взять определенное количество кислоты (например, соляной кислоты) и добавить ее к определенному количеству оксида металла (например, оксида железа). Затем наблюдать химическую реакцию и записывать полученные результаты.
Какие значения можно получить в результате лабораторной работы?
В результате лабораторной работы можно получить такие значения, как степень растворимости оксида металла в кислоте, pH раствора после реакции, количество выделившегося газа и др. Эти значения позволяют сделать выводы о свойствах и характере взаимодействия кислоты с оксидом металла.
Какие практические применения может иметь изучение взаимодействия кислот с оксидами металлов?
Изучение взаимодействия кислот с оксидами металлов имеет практическое применение в различных областях. Например, это может быть использовано для производства различных химических соединений, включая препараты, косметические средства, окраски и пигменты. Также это знание может быть полезно для определения качества и состава материалов, в технологии производства и многих других областях.
