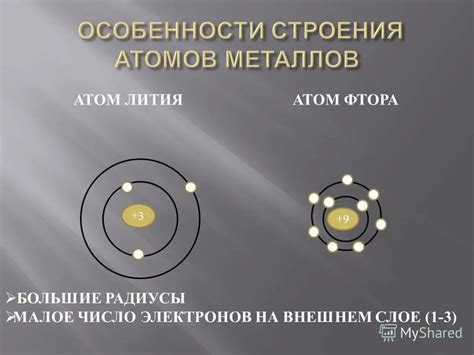
Атомы металлов и неметаллов отличаются не только по химическим свойствам, но и по своему кристаллическому строению. Кристаллическая структура атомов металлов обладает определенными особенностями, которые отличают ее от кристаллической структуры атомов неметаллов.
Одним из основных отличий является расположение атомов в кристаллической решетке. В металлах атомы образуют регулярную решетку, в которой они располагаются в виде идентично ориентированных кристаллов. В неметаллах же атомы образуют неупорядоченную решетку, где их расположение не подчиняется строгим правилам.
Кроме того, атомы металлов характеризуются высокой подвижностью. В кристаллической решетке они могут свободно перемещаться, что обеспечивает хорошую проводимость электричества и тепла. В отличие от них, атомы неметаллов зачастую тесно связаны друг с другом и не обладают такой высокой подвижностью.
Наконец, кристаллическая структура атомов металлов часто обладает симметрией, что обусловлено их регулярным расположением в решетке. В то время как кристаллическая решетка атомов неметаллов часто обладает менее симметричной структурой.
Кристаллическое строение атомов металлов: особенности и отличия
Металлы - это группа элементов, которые отличаются своими физическими и химическими свойствами от других элементов. Кристаллическое строение атомов металлов является одной из их особенностей.
Основным отличием металлов от неметаллов является их способность образовывать кристаллические решетки. Такие решетки образуются благодаря способности атомов металлов образовывать межатомные связи. В результате образуется трехмерная структура, которая обладает определенной симметрией.
У атомов металлов чаще всего имеются свободные электроны в валентной области. Эти электроны образуют так называемое "море электронов". Они являются общими для всех атомов в кристаллической решетке и способствуют проводимости электрического тока в металлах.
В кристаллической решетке металлов атомы располагаются близко друг к другу и образуют регулярную структуру. Из-за этого кристаллическое строение металлов часто характеризуется высокой плотностью и металлическим блеском.
Кристаллическое строение металлов также обуславливает их способность к деформации. При механическом воздействии на металл, атомы смещаются искажая кристаллическую решетку. Это позволяет металлам пластически деформироваться и сохранять свою прочность.
Симметрия и физические свойства

Кристаллическое строение атомов металлов отличается от атомов неметаллов в основном по своей симметрии, что влияет на их физические свойства.
Атомы металлов обладают высокой степенью симметрии благодаря регулярному расположению на решетке. Это приводит к возникновению кристаллической структуры, которая характеризуется геометрическими фигурами, такими как кубы, шестиугольники и тетраэдры.
Такая симметрия обуславливает множество физических свойств металлов. Например, у металлов высокая электропроводность и теплопроводность, связанные с легкостью движения электронов в решетке. Электроны могут свободно перемещаться по кристаллу, создавая электрический ток и передавая тепло.
Кристаллическое строение также влияет на механические свойства металлов. Благодаря высокой степени симметрии, металлы обладают пластичностью и деформируются без разрушения при механическом напряжении. Это позволяет использовать металлы для создания различных конструкций и деталей.
Металлическое связывание и структура кристаллической решетки
Металлическое связывание – это тип химической связи, присущий металлам, который характеризуется высокой подвижностью электронов, тем самым обеспечивая металлам их основные свойства, такие как электропроводность и теплопроводность.
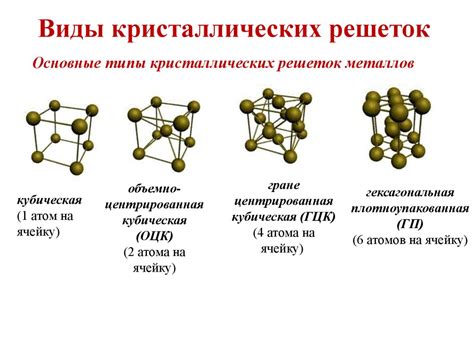
Металлы обладают кристаллической структурой, то есть их атомы располагаются в определенном порядке и образуют кристаллическую решетку. В отличие от неметаллов, у которых атомы образуют молекулы, атомы металлов образуют ионную решетку, в которой позитивно заряженные ионы металла окружены свободно движущимися электронами.
Структура кристаллической решетки металлов определяется их кристаллической решеткой, которая может быть различного типа: простой кубической, гранецентрированной кубической, гексагональной и т. д. Кристаллическая решетка металлов обладает высокой степенью симметрии, что является одной из причин их механической прочности и пластичности.
В заключение, металлы отличаются от неметаллов своим металлическим связыванием и структурой кристаллической решетки. Это связывание позволяет металлам обладать такими уникальными свойствами, как электропроводность и теплопроводность. Кристаллическая решетка металлов обеспечивает им прочность и пластичность.
Свойства и поведение металлических элементов
Металлы являются основным классом химических элементов, характеризующихся определенными свойствами и поведением. Одним из важных свойств металлов является их электропроводность. Металлы являются хорошими проводниками электричества благодаря наличию свободных электронов в их кристаллической решетке. Эти электроны могут свободно перемещаться по металлической структуре, что позволяет металлам проводить электрический ток. Благодаря своей высокой электропроводности, металлы широко используются в производстве электрических проводов и других элементов электротехники.
Еще одним характерным свойством металлов является их хорошая теплопроводность. Металлы обладают высокой способностью передавать тепло от одного места к другому. Это особенно полезное свойство в случае, когда требуется мгновенное распределение и отвод тепла. Благодаря своей теплопроводности, металлы широко используются в производстве теплообменников, радиаторов и других устройств для охлаждения и нагрева.
Металлы также обладают высокой механической прочностью и устойчивостью к деформации. Они способны выдерживать большие нагрузки и сохранять свою форму даже при значительных воздействиях. Это свойство делает металлы ценными материалами в строительстве, производстве машиностроительных деталей и других областях промышленности, где требуется прочность и устойчивость к механическим воздействиям.
Также металлы обладают характерной блескучестью. Поверхность металлов отражает свет, что делает их видяными нашим глазом. Благодаря своему блеску, металлы широко применяются в ювелирном искусстве, а также в производстве украшений и декоративных элементов.
Таким образом, металлы обладают рядом характерных свойств и поведением, благодаря которым они находят широкое применение в различных сферах человеческой деятельности.
Неметаллические атомы: кристаллическое строение и химические свойства
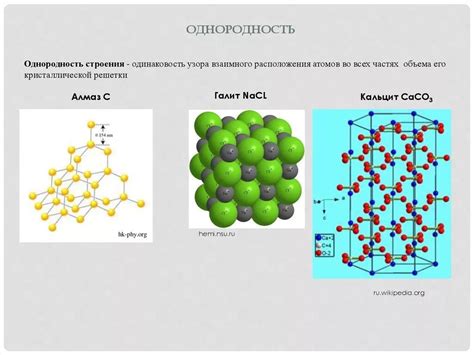
Неметаллические атомы имеют различное кристаллическое строение, отличающееся от структуры металлических атомов. Вместо тесноупакованной решетки металлов, неметаллы образуют более сложные структуры, которые могут быть аморфными или молекулярными.
Молекулярное кристаллическое строение представляет собой сеть молекул, связанных слабыми межмолекулярными силами. Примеры неметаллических молекулярных кристаллов включают графит и алмаз - различные формы углерода. Графит представляет собой слоистую структуру, где каждый атом углерода связан с трех другими атомами в плоскости, образуя слои. Алмаз же имеет трехмерную кристаллическую решетку, где каждый атом углерода связан с четырьмя атомами в трехмерном пространстве, образуя твердое кристаллическое вещество.
Неметаллические молекулы обычно обладают высокими значениями электроотрицательности и могут образовывать ковалентные иионные связи. Это важно для определения их химических свойств. Неметаллы часто обладают высокой реактивностью и могут образовывать разнообразные соединения.
Некоторые неметаллы, такие как кислород и азот, образуют молекулы, состоящие из двух одинаковых атомов и называются диатомическими молекулами. Диатомические молекулы располагаются в пространстве с определенными углами и могут образовывать различные кристаллические структуры. Например, кислород может образовывать трехатомные кристаллы озона, азот может образовывать кристаллы азотной кислоты и других соединений.
В целом, неметаллические атомы обладают разнообразными кристаллическими структурами и химическими свойствами, которые сильно отличаются от металлических атомов. Изучение этих отличий помогает нам лучше понять поведение неметаллов и их роль в различных химических реакциях и соединениях.
Вопрос-ответ

