Ковалентная связь является одной из основных форм химической связи, возникающей между двумя атомами. Она основана на обмене электронами между атомами и характеризуется общим использованием электронных оболочек атомов. Металлы, в свою очередь, известны своей способностью образовывать ионные связи и образовывать кристаллическую решетку.
Однако, существует особый тип связи, называемый металлической связью. Он характеризуется образованием свободных электронов внешней оболочки металлических атомов, которые способны перемещаться в кристаллической решетке. Это, в свою очередь, обуславливает хорошую электропроводность и теплопроводность у металлов.
Несмотря на то, что ковалентная связь является наиболее распространенной формой связи между атомами, она не характерна для металлов. Металлическая связь обеспечивает специфические свойства металлов и позволяет им образовывать сложные структуры, такие как сплавы. Таким образом, ковалентная связь в металлах, в строгом смысле, отсутствует, и металлы не образуют молекул в привычном смысле этого слова.
Возможность ковалентной связи металлов

Металлы обычно характеризуются высокой электропроводностью и металлическим блеском, что говорит о наличии свободных электронов в их структуре. Стандартная модель связи в металлических соединениях предполагает наличие так называемой металлической связи, основанной на взаимодействии между положительными ионообразными ядрами металла и свободными электронами. Однако, некоторые металлы также могут образовывать ковалентные связи, характерные для неметаллов.
Ковалентная связь между атомами металла может возникать в случаях, когда металлические элементы образуют соединения с неметаллами. Например, в молекуле водорода и молекуле сероводорода ковалентная связь образуется между атомами водорода и серы соответственно. В таких случаях, ковалентная связь с металлами возникает из-за наличия электронного перекрытия между атомами.
Однако, стоит отметить, что ковалентная связь между атомами металла является гораздо слабее, чем металлическая связь. Это связано с меньшей электроотрицательностью металлов по сравнению с неметаллами, что приводит к недостаточному электронному перекрытию и более слабой связи. Кроме того, в ковалентных соединениях с металлами, ковалентная связь может сопутствовать металлической связи, что дает им особые физические и химические свойства.
Таким образом, хотя металлическая связь является наиболее распространенной формой связи в металлах, возможность ковалентной связи с некоторыми неметаллами позволяет металлам формировать разнообразные ковалентные соединения с уникальными свойствами.
Проблема определения ковалентности связи
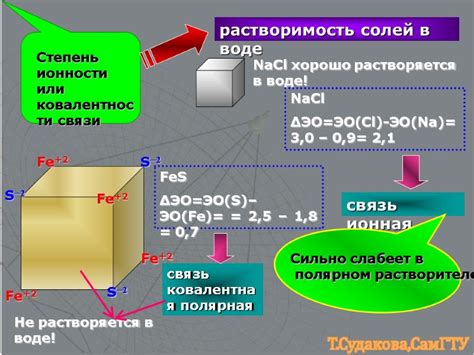
Ковалентная связь – это тип химической связи, при котором атомы в молекуле разделяют пару электронов. Однако, в случае взаимодействия с металлами, возникает проблема определения ковалентности связи. Дело в том, что у металлов уровень энергии d-субуровня и уровень энергии s-подслоя близки по энергетическим характеристикам.
Металлическая связь формируется как результат перемещения электронов с s-подслоя на d-субуровень и обратно. Это значит, что на фоне металлической связи ковалентность может оказаться неоднозначной. Помимо того, металлические элементы обладают значительной электроотрицательностью, что усложняет определение их связей.
В химии существуют различные модели и теории, пытающиеся объяснить природу химических связей, особенно связей между металлами и неметаллами. Например, теория В.Н. Никольского-Эрёминова предлагает классифицировать связи между металлами и неметаллами по степени ковалентности и ионности.
Таким образом, проблема определения ковалентности связи с металлами связана с наличием металлической связи и близостью уровней энергии s-подслоя и d-субуровня. Для более точного определения степени ковалентности используются различные теории и модели, учитывающие эти особенности.
Электроотрицательность – ключевой фактор
Для того, чтобы понять возможность ковалентной связи с металлами, необходимо учитывать электроотрицательность. Электроотрицательность – это величина, отражающая способность атома притягивать электроны к себе в химической связи. В связях с металлами электроотрицательность обычно невысокая, поэтому образование ковалентной связи в таких случаях не является характерным.
Тем не менее, есть некоторые исключения, когда металлы могут образовывать ковалентные связи. Это связано с тем, что некоторые металлы могут иметь более высокую электроотрицательность, чем обычно. Например, с помощью введения в металлическую матрицу элементов с высокой электроотрицательностью можно достичь образования ковалентных связей с металлом.
Кроме того, некоторые металлы могут образовывать ковалентные связи в определенных условиях, например, при высокой концентрации различных компонентов или в присутствии сильных кислот или оснований. В таких случаях возможно образование ковалентных комплексов, в которых металл связан с другими элементами через ковалентные связи.
Аномальное поведение некоторых металлов

Металлы обычно характеризуются ковалентной связью, которая образуется между атомами металла и электронами. Однако, существуют определенные случаи, когда металлы проявляют аномальное поведение в химических реакциях.
Один из примеров аномального поведения металлов - галлий. При комнатной температуре он обычно жидкий, что противоречит ожиданиям для металлов. Это связано с тем, что атомы галлия образуют слабые связи между собой, что приводит к низкой точке плавления.
Еще одним примером является ртуть. Она также является жидким при комнатной температуре, что противоречит типичным свойствам металлов. Это объясняется тем, что ртуть образует специфическую кристаллическую решетку, которая не позволяет молекулам сформировать ковалентные связи.
Еще одним интересным случаем является германий. Этот металл имеет особенность, что он становится полупроводником при низких температурах. Это объясняется тем, что в кристаллической структуре германия атомы образуют кольца, которые могут легко передавать электроны.
Таким образом, хотя металлы обычно обладают ковалентной связью, некоторые металлы могут проявлять аномальное поведение в связи с особенностями их атомной структуры и взаимодействием с электронами.
Вопрос-ответ

Можно ли установить ковалентную связь между атомами металлов?
Да, возможно. Хотя металлы обычно формируют металлическую связь, где электроны свободно движутся между атомами металла, некоторые металлы могут образовывать ковалентные связи. Например, в кластерах металлов или в некоторых металлорганических соединениях.
Какие металлы могут образовывать ковалентные связи?
Литий, бериллий, бор, алюминий и другие легкие металлы способны образовывать ковалентные связи. Это связано с тем, что они имеют более низкую электроотрицательность, что способствует общему использованию электронов между атомами.
Как происходит образование ковалентной связи с металлом?
При образовании ковалентной связи с металлом, один атом металла отдает электроны другому атому, образуя пару связывающих электронов. Эта связь является ковалентной, так как электроны общие между атомами и образуют пару связывающих электронов.
Каковы свойства металлов с ковалентными связями?
Металлы, формирующие ковалентные связи, обычно обладают более высокой твердостью, высокой температурой плавления и свойствами полупроводников. Их электрическая и теплопроводность может быть более слабой по сравнению с металлами, образующими металлическую связь.
