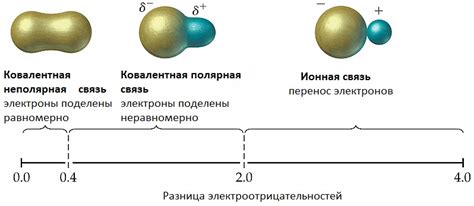
Ковалентная связь – это тип химической связи между атомами, при котором они обмениваются электронами для образования пары с общими электронами. У большинства веществ ковалентная связь образуется между атомами неметаллов, однако она также может возникать и между атомами металлов.
Многие металлы формируют лиганды – специальные группы атомов или ионов, которые становятся мостиками между двумя металлическими атомами. Кортикальные связи могут создавать комплексы, в которых атомы металла делятся на две группы и образуют две ковалентные связи.
Примером такого комплекса является металлокарбонил, где атом металла связан с двумя атомами углерода через ковалентные связи. Такие связи между двумя металлами могут быть сильными и стабильными, что делает такие соединения важными для многих индустриальных и химических процессов.
Образование ковалентной связи между двумя металлами происходит благодаря наложению областей электронной плотности двух атомов. В результате этого процесса образуется новая область электронной плотности, в которой электроны между двумя атомами распределены симметрично. Такая связь между металлическими атомами называется ковалентной связью.
Формирование химической связи между металлами
Химическая связь между металлами представляет собой ковалентную связь, которая образуется путем обмена электронами между атомами металлов. Это особый тип химической связи, который ведет к образованию металлической решетки.
Процесс образования химической связи между металлами начинается с приближения атомов металлов друг к другу. При достаточно малом расстоянии между атомами металлов происходит перекрывание их энергетических уровней, что позволяет электронам образовать общие орбитали с несколькими атомами металлов.
Ковалентная связь между металлами характеризуется положительной полярностью, так как электроны притягиваются электростатическими силами к положительно заряженным атомным ядрам. Это обеспечивает устойчивость металлической решетки и ее прочность.
Формирование химической связи между металлами позволяет образовывать различные сплавы, которые обладают уникальными свойствами. Сплавы могут иметь более высокую твердость, прочность, пластичность, электропроводность и другие свойства, чем исходные металлы.
Важным аспектом формирования химической связи между металлами является выбор соответствующих металлов. Различные комбинации могут обеспечить разное сочетание свойств. Например, добавление цинка к меди позволяет получить сплав латуни, который обладает высокой коррозионной стойкостью и используется в производстве различных изделий.
Как металлы образуют ковалентную связь
Ковалентная связь – это тип химической связи между атомами, основанный на обмене электронами между ними. Обычно ковалентная связь возникает между неметаллами, однако и металлы могут образовывать ковалентные связи между собой.
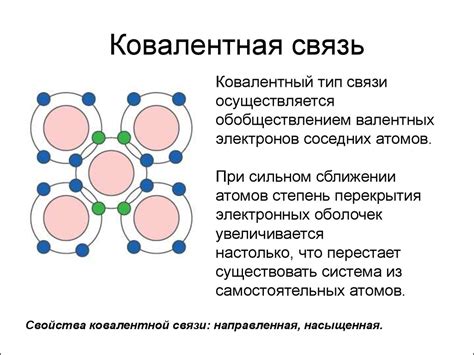
Ковалентная связь между металлами возникает в результате наложения их электронных облаков. При этом происходит общее использование электронов обоими атомами металла, что обусловлено гибкой структурой и его способностью давать электроны. Такие связи между металлами называются металлическими связями.
В металлической связи часть электронов отделяется от атома металла и образует электронное облако, которое окружает положительно заряженные ионы. Электроны в металлической связи не принадлежат конкретному атому, а движутся свободно внутри металлической структуры.
При образовании ковалентной связи между металлами, образуется жесткая и прочная структура, которая обеспечивает их высокую проводимость электрического тока и тепла. Также металлические связи обуславливают хорошую пластичность, что позволяет металлам принимать различные формы.
Металлические связи обладают определенными свойствами, которые отличают их от ковалентных связей между неметаллами. Образуясь, металлические связи формируют решетку атомов металла, где каждый атом металла окружен несколькими соседними атомами. Такая решетка обеспечивает металлам высокую устойчивость и прочность.
Важность образования ковалентной связи между металлами
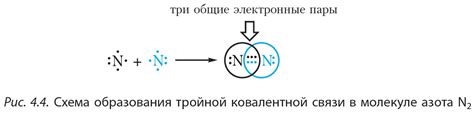
Образование ковалентной связи между металлами играет важную роль во многих аспектах нашей жизни. Ковалентная связь возникает, когда два атома металлов делят свои внешние электроны, создавая общую область электронного облака.
Первоначально, такая связь позволяет металлам образовывать кристаллическую структуру, что делает их прочными и устойчивыми. Кристаллическая решетка, образованная благодаря ковалентной связи, даёт металлам способность выдерживать большие механические нагрузки и терять мало энергии в виде тепла.
Ковалентная связь также влияет на химические свойства металлов, позволяя им образовывать соединения с другими элементами. Благодаря возможности обмена электронами, металлы могут образовывать ионы различной зарядности и участвовать в различных химических реакциях.
Кроме того, образование ковалентной связи между металлами играет важную роль в электронике и электротехнике. Металлы, связанные ковалентной связью, обладают хорошей электропроводимостью, благодаря способности электронов двигаться свободно в общей области электронного облака. Это позволяет использовать металлы для создания проводников, контактов и других электронных компонентов.
Таким образом, образование ковалентной связи между металлами имеет огромное значение в различных областях нашей жизни, от строительства и машиностроения до химической и электротехнической промышленности.
Механизмы образования ковалентной связи
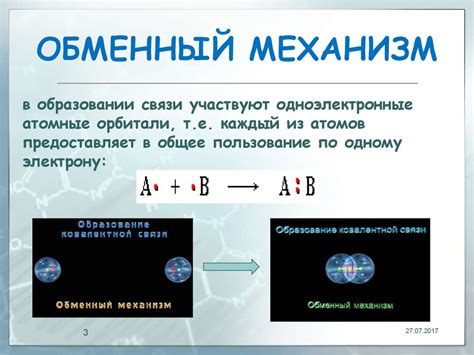
Образование ковалентной связи между двумя металлами может происходить по различным механизмам. Один из них - обмен электронами между атомами металлов. В этом механизме каждый атом отдает или принимает электроны, образуя общую электронную оболочку. Такой обмен электронами позволяет металлам сформировать стабильную ковалентную связь и образовать межатомные соединения.
Другим механизмом образования ковалентной связи между металлами является смешивание электронных орбиталей. В этом механизме электроны из различных орбиталей металлов смешиваются, образуя новые орбитали, которые принадлежат обоим металлам. Такой механизм связывает металлы и позволяет им образовать структуры с дополнительной связью между атомами.
Третий механизм образования ковалентной связи между металлами связан с образованием координационной связи. В этом механизме один металл предоставляет пару электронов, которая передается на соседний металл, образуя ковалентную связь. Такой механизм образования связи позволяет металлам устанавливать особые взаимодействия и формировать разнообразные соединения с устойчивой ковалентной структурой.
Механизмы образования ковалентной связи между двумя металлами являются основой для понимания металлической химии и формирования новых материалов с уникальными свойствами. Изучение этих механизмов позволяет расширить наши знания о металлах и их взаимодействии, а также разработать новые подходы к созданию современных материалов и технологий.
Образование связи через обмен электронами
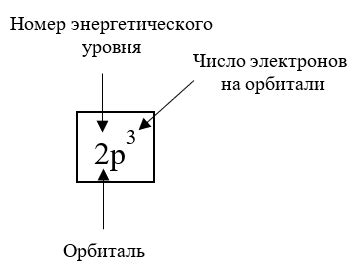
Ковалентная связь между двумя металлами возникает при обмене электронами между атомами металлов. Общий электронный газ, характерный для металлов, позволяет создать сильную и долговечную связь между ними.
Образование связи начинается с ионизации атомов металла, при которой электроны переходят из валентной оболочки одного атома на валентную оболочку другого атома. Затем происходит обмен электронами между атомами, который приводит к образованию общего электронного газа.
Обмен электронами позволяет стабилизировать оба атома, так как каждый из них получает от общего электронного газа недостающие электроны для достижения полной валентной оболочки. В результате образуется ковалентная связь, при которой атомы металлов образуют между собой электронные пары с общими электронами.
Такая связь является очень прочной и устойчивой. Атомы металлов становятся частично ионизованными и образуют положительно заряженные ионы, окруженные общим электронным облаком. Благодаря этой структуре металлы обладают высокой электропроводностью и теплопроводностью, а также хорошей пластичностью и деформируемостью.
Образование связи через общие электронные облака
Образование ковалентной связи между двумя металлами происходит благодаря общению и обмену электронами между их внешними энергетическими оболочками. Электроны, находящиеся на внешних оболочках атомов, могут переходить с одного атома на другой, образуя общие электронные облака. Этот процесс называется образованием связи через общие электронные облака.
Когда два металла находятся вблизи друг друга, их внешние энергетические оболочки начинают перемещаться и обмениваться электронами. Этот процесс приводит к тому, что у обоих металлов возникает общая оболочка, состоящая из общих электронных облаков. Таким образом, металлы становятся связанными друг с другом через эти облака.
Образование связи через общие электронные облака ведёт к образованию ковалентных связей между двумя металлами. За счет обмена электронами, связь становится очень прочной и устойчивой. Уровень энергии в обоих металлах становится более стабильным и снижается их реактивность.
В результате образования связи через общие электронные облака между двумя металлами, оба металла приобретают более устойчивую структуру и общие характеристики. Такая связь играет важную роль в различных химических реакциях и процессах, связанных с металлами и их соединениями.
Вопрос-ответ

Как образуется ковалентная связь между двумя металлами?
Ковалентная связь между двумя металлами образуется путем обмена электронами между их внешними электронными оболочками. Металлы имеют небольшую электроотрицательность, поэтому электроны между ними распределяются равномерно, образуя общую область электронной плотности, которая связывает атомы металлов.
Какие металлы могут образовывать ковалентную связь друг с другом?
Ковалентная связь между металлами может образовываться при наличии подходящих электронных конфигураций и схожих электроотрицательностей. Некоторые примеры металлов, способных образовывать ковалентную связь друг с другом, включают алюминий и магний, железо и никель, а также медь и цинк.
Влияет ли длина ковалентной связи на ее прочность?
Да, длина ковалентной связи между двумя металлами может влиять на ее прочность. Обычно короткие ковалентные связи более прочные, так как их электроны находятся ближе к ядрам атомов и их взаимодействие сильнее. Однако это может зависеть от других факторов, таких как размеры атомов и степень перекрытия их электронных облаков.
