Ковалентная неполярная связь - один из фундаментальных типов химических связей, исключительно важный для объяснения химических свойств многих соединений. Она возникает при взаимодействии атомов, когда они образуют пару электронов и делят ее между собой. В результате образуется электронная оболочка обоих атомов, обеспечивающая их стабильность.
Однако, ковалентная неполярная связь проявляется по-разному в металлах и неметаллах. В металлах связи образуются между атомами металла, которые могут иметь множество подобных электронов в своей валентной оболочке. Это обеспечивает высокую электропроводимость и теплопроводность металлов.
В неметаллах связи образуются между атомом неметалла и одним или несколькими атомами водорода или другого неметалла. В данном случае электроотрицательность играет важную роль: атомы с большей электроотрицательностью сильнее притягивают общие электроны, создавая полярность связи.
Примером ковалентной неполярной связи в металле является межатомная связь в кристаллической решетке металлов, которая способствует их металлическим свойствам. Как примеры ковалентной неполярной связи в неметаллах можно привести связь между атомами кислорода в молекуле воды или связи между атомами углерода в молекуле метана.
Ковалентная неполярная связь является ключевым аспектом в химии и важным для понимания свойств веществ. Она объясняет множество химических реакций и явлений, и ее изучение позволяет лучше понять взаимодействие атомов и молекул.
Ковалентная неполярная связь
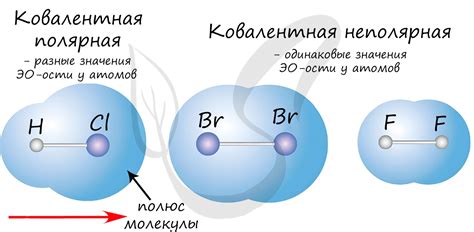
Ковалентная неполярная связь - это тип химической связи, в которой два атома делят одну или несколько пар электронов между собой. Данный тип связи возникает между атомами металлов и неметаллов с сходными электроотрицательностями.
Ковалентная неполярная связь образуется, когда оба атома делят пары электронов равномерно и с одинаковой интенсивностью, не создавая никакого положительного или отрицательного заряда. Такая связь часто встречается в соединениях ковалентного характера, таких как молекулы газов и органические соединения.
В ковалентной неполярной связи силы, действующие между атомами, равны и симметричны. Такие связи могут образовывать одиночные, двойные или тройные связи. При этом, открытая электронная оболочка всех атомов в соединении становится полностью насыщенной.
Примеры соединений с ковалентной неполярной связью включают молекулы кислорода (O2), азота (N2) и метана (CH4). В этих молекулах атомы делят электронные пары с равной интенсивностью, что позволяет им образовывать стабильные молекулярные структуры.
Определение и основные принципы
Ковалентная неполярная связь является одним из видов химической связи между атомами вещества. Она возникает в результате совместного использования электронов внешней оболочки атомами, чтобы достигнуть наиболее стабильного состояния. Ковалентная неполярная связь образуется между атомами неметаллов или металлов, и она характеризуется равномерным распределением электронной плотности.
Основной принцип ковалентной неполярной связи заключается в том, что каждый атом участвующего в связи элемента вносит свои электроны в общую электронную оболочку. При этом, электроны становятся общими для обоих атомов, образуя общую связывающую пару. Электроны совместно используются атомами, что приводит к установлению равновесия между электронами и ядрами атомов.
Важным аспектом ковалентной неполярной связи является равномерное распределение электронной плотности. Это означает, что электроны в связи равномерно распределены между атомами, и каждый атом получает равную долю электронов. Такая равномерность обеспечивает стабильность связей и формирование прочного соединения.
Примером ковалентной неполярной связи является связь между двумя атомами кислорода в молекуле O2. В этом случае, каждый атом кислорода вносит два электрона в общую электронную оболочку, образуя две общие связывающие пары. Такая связь обеспечивает стабильность и газообразное состояние молекулы O2 при комнатной температуре и давлении.
Ключевые аспекты связи в металлах
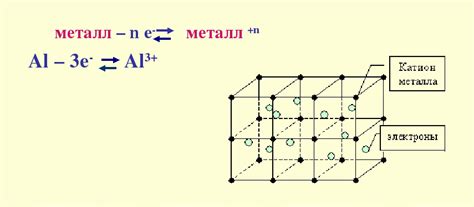
Ковалентная неполярная связь в металлах является одним из важных аспектов их структуры и свойств. Она основывается на обмене электронами между атомами и образовании сети металлических связей.
Одним из ключевых аспектов этой связи является существование свободных электронов в металлической решетке. Эти свободные электроны могут двигаться свободно по всей структуре металла, что придает ему его металлические свойства, такие как хорошая электропроводность и теплопроводность.
Свободные электроны также отвечают за способность металлов проводить ток и энергию без значительного сопротивления. Они образуют "море электронов", которое перемещается вдоль металлических связей под воздействием внешнего электрического поля.
Ковалентная неполярная связь в металлах также обеспечивает высокую прочность и твердость материала. Это связано с упорядоченной структурой металлической решетки и способностью атомов образовывать большое количество связей соседних атомов.
Важным аспектом связи в металлах является также наличие диэлектрической прослойки между связанными атомами в металлической решетке. Эта прослойка предотвращает сильное отталкивание и электростатический отталкивающий заряд между атомами, что делает металл структурой стабильной и устойчивой.
В целом, ковалентная неполярная связь в металлах обеспечивает уникальные свойства этого класса материалов. Она определяет их проводимость, прочность и другие характеристики, делая металлы важными строительными блоками для множества промышленных и технологических приложений.
Ключевые аспекты связи в неметаллах

Ковалентная неполярная связь в неметаллах является одним из основных типов химической связи в природе. Она возникает между атомами неметаллов благодаря перекрытию и общему использованию электронов в их внешних энергетических оболочках.
Важным аспектом связи в неметаллах является симметрия перекрытия электронных облаков атомов. Чем выше степень симметрии, тем сильнее связь между атомами и тем выше энергия связи. В результате неметаллы образуют молекулы с определенной геометрией, которая определяется электронной структурой и характером химических связей.
Ковалентная неполярная связь в неметаллах обладает высокой прочностью и стабильностью. Она обеспечивает устойчивость молекул и полимеров, что позволяет неметаллам образовывать различные соединения с разнообразными физическими и химическими свойствами.
Примерами неметаллов, образующих ковалентную неполярную связь, являются кислород, азот, углерод и фтор. Кислород образует молекулы воды (H2O), где каждый атом кислорода связан с двумя атомами водорода. Азот образует молекулы азота (N2), где два атома азота связаны между собой тройной связью. Углерод образует молекулы углекислого газа (CO2), где каждый атом углерода связан с двумя атомами кислорода двойной связью. Фтор образует молекулы фторида кальция (CaF2), где каждый атом фтора связан с атомом кальция и образует кристаллическую решетку.
Примеры ковалентной неполярной связи

Ковалентная неполярная связь проявляется в различных химических соединениях. Одним из примеров такой связи является молекула кислорода (O2). В этой молекуле два атома кислорода образуют сильную ковалентную связь, в результате которой они обмениваются парами электронов. Это позволяет кислороду образовывать двойные связи с другими элементами.
Еще одним примером ковалентной неполярной связи является молекула метана (CH4). В молекуле метана четыре атома водорода образуют ковалентную связь с атомом углерода. Все электроны в этой связи распределены равномерно между атомами, что делает молекулу метана неполярной.
Также стоит отметить ковалентную неполярную связь в молекуле азота (N2). В этой молекуле два атома азота образуют ковалентную двойную связь, в результате которой оба атома получают пару электронов. Это делает молекулу азота неполярной и устойчивой.
Другим примером ковалентной неполярной связи является молекула диатомического водорода (H2). В этой молекуле два атома водорода образуют ковалентную связь, обмениваясь парами электронов. Результирующая молекула неполярна и обладает высокой химической устойчивостью.
Вопрос-ответ

Какая связь существует в металлах?
В металлах существует ковалентная неполярная связь, которая образуется между атомами металла. Эта связь характеризуется общими электронами, которые мобильны в металлической решетке и образуют электронное облако.
Как выглядит ковалентная неполярная связь в неметаллах?
В неметаллах ковалентная неполярная связь образуется между атомами неметалла и характеризуется равным распределением электронной плотности между атомами. В такой связи все электроны являются общими и одинаково притягиваются обоими атомами.
Какие примеры ковалентной неполярной связи можно привести?
Примерами ковалентной неполярной связи в металлах могут служить железо, алюминий, медь и другие металлы. Примеры в неметаллах включают молекулы кислорода, азота, водорода и др.
