Металлы широко используются в нашей повседневной жизни, однако они подвержены различным химическим процессам, среди которых особое место занимает коррозия. Коррозия металлов – это нежелательное явление, когда в результате химических процессов на поверхности металла образуются окислы или гидроксиды, что приводит к ухудшению его свойств и даже разрушению.
Процесс коррозии металлов может развиваться при контакте с воздухом, водой или другими химическими веществами. Он осуществляется за счет ряда электрохимических реакций, происходящих на поверхности металла. Основными участниками этих реакций являются кислород, вода и электролиты.
Особенностью коррозии металлов является то, что она может происходить как на видимой, так и на невидимой поверхности металла. Внешне металл может выглядеть целым и неповрежденным, но в то же время внутри материала уже происходят процессы разрушения. Поэтому, для выявления коррозии, необходимо проводить регулярные проверки металлоконструкций и предпринимать соответствующие меры по их защите и ремонту.
Коррозия металлов: схема и особенности химических процессов
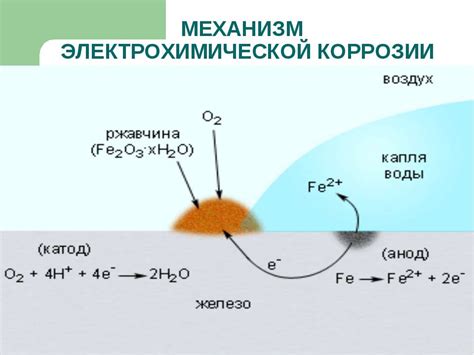
Коррозия металлов является распространенным и нежелательным явлением, сопровождающимся химическим разрушением материала. Она вызвана реакцией металла с окружающей средой, такой как влага, газы или пыль, и приводит к потере структурной прочности и функциональности металлических изделий.
Основной механизм коррозии металлов состоит из трех стадий: анодного процесса, катодного процесса и протекания ионного переноса через электролит. На аноде происходит окисление металла, при котором образуется ионы металла и электроны. На катоде происходит восстановление электронов и ионов вещества, причем, именно катодные процессы определяют общую скорость коррозии.
Особенности химических процессов при коррозии металлов зависят от многих факторов, включая характеристики металла, его защитные покрытия, окружающую среду и условия эксплуатации. Различные металлы имеют различную степень подверженности коррозии, так как их электрохимические свойства могут различаться. Некоторые металлы, такие как алюминий и цинк, способны образовывать защитные слои оксидов, которые могут предотвратить или замедлить коррозию.
Одним из способов защиты от коррозии металлов является использование покрытий, таких как оксидные пленки или покрытия, содержащие цинк или олово. Также можно применять методы электрохимической защиты, такие как катодная защита или анодная защита, которые основаны на введении дополнительных анодных или катодных систем в окружающую среду.
Понимание схемы и особенностей химических процессов, протекающих при коррозии металлов, позволяет разработать эффективные методы предотвращения и защиты от коррозии, а также помогает в выборе правильных материалов для конкретных задач.
Причины и механизмы коррозии металлов
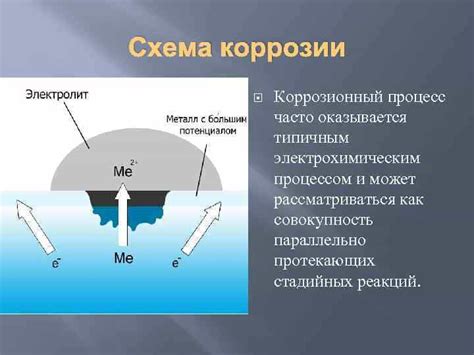
Коррозия металлов является нежелательным процессом, который приводит к разрушению и повреждению материалов. Она происходит под влиянием различных факторов, как внешних, так и внутренних.
Одной из основных причин коррозии является воздействие окружающей среды на металлы. Воздух, вода, почва, химические вещества и др. могут содержать агрессивные компоненты, которые реагируют с металлами и вызывают коррозию. Например, кислород и влага воздуха при присутствии ионов металла образуют оксиды, которые вызывают окислительные процессы на поверхности металла.
Коррозия металлов осуществляется по различным механизмам. Наиболее распространенными являются электрохимическая коррозия и химическая коррозия. В электрохимическом механизме происходит образование анодов и катодов на поверхности металла, а затем движение электрических зарядов между ними, вызывая растворение металла или образование осадка. Химическая же коррозия связана с прямыми химическими реакциями металла с веществами в окружающей среде.
Повреждение металла при коррозии может происходить как на поверхности, так и внутри его структуры. Например, при коррозии железа образуются ржавчина и неплотные слои оксидов на поверхности, которые отслаиваются и оставляют место для продолжения процесса коррозии. Кроме того, металлы могут подвергаться интеркристаллической или межкристаллической коррозии, когда происходит разрушение межкристаллической структуры материала.
Для защиты металлов от коррозии используются различные методы, включая нанесение защитных покрытий, использование специальных добавок или покрытий, контроль окружающей среды и другие. Понимание причин и механизмов коррозии позволяет разработать эффективные методы защиты и обеспечить долговечность металлических конструкций и изделий.
Электрохимическая теория коррозии

Коррозия металлов - это процесс распада металла под влиянием окружающей среды. Одна из наиболее распространенных теорий, объясняющих механизм коррозии, - это электрохимическая теория. Согласно этой теории, коррозия происходит из-за электрохимических реакций, которые происходят на поверхности металла.
Основной принцип электрохимической теории коррозии состоит в том, что металл работает как анод и катод одновременно. Под влиянием внешних факторов, таких как влажность, кислотность среды или наличие ионов металла, на поверхности металла происходят окислительно-восстановительные реакции.
В электрохимической теории коррозии различают два процесса - анодный и катодный. Анодный процесс характеризуется окислением металла, при этом металл выделяет электроны и превращается в ионы, которые переходят в раствор. Катодный процесс, напротив, связан с восстановлением ионов металла, при этом электроны из раствора переходят на поверхность металла.
Особенностью электрохимической теории коррозии является то, что коррозия может происходить только при наличии электролита, т.е. вещества, способного проводить электрический ток. Поэтому для происхождения коррозии необходимо наличие влаги или влажной среды.
Понимание электрохимической теории коррозии позволяет разрабатывать методы защиты от коррозии металлов, такие как использование антикоррозионных покрытий, а также подбор материалов, устойчивых к коррозии в данной среде.
Виды коррозии металлов

Коррозия является процессом разрушения металла под воздействием окружающей среды. В зависимости от условий, в которых происходит коррозия, можно выделить несколько видов этого процесса.
- Аэробная коррозия. Происходит в присутствии кислорода и влаги. Такая коррозия характерна для металлов, которые не образуют защитную пленку, например, железа и стали.
- Анодная коррозия. Происходит при наличии анодных и катодных областей на металле, что вызывает электрохимический процесс коррозии.
- Контактная коррозия. Возникает при контакте различных металлов в присутствии электролита. При этом один металл выступает в качестве анода, а другой – катода.
- Межкристаллитная коррозия. Возникает в местах соединения зерен металла и приводит к разрушению межкристаллитных связей.
Кроме того, можно выделить также такие виды коррозии, как поверхностная коррозия, пятнистая коррозия, интеркристаллическая коррозия и др. Каждый вид коррозии имеет свои особенности и способы предотвращения.
Процессы защиты от коррозии
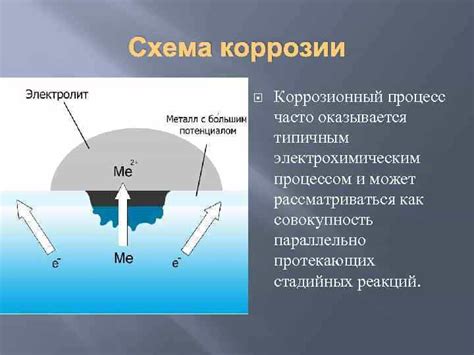
Коррозия металлов является естественным процессом, но благодаря современным технологиям и материалам, возможно защитить металлы от негативного воздействия окружающей среды. В данном разделе рассмотрим некоторые процессы защиты от коррозии.
Одним из самых простых и доступных способов защиты от коррозии является нанесение защитного слоя на поверхность металла. Для этого часто используются специальные краски и лаки, которые образуют плотную пленку на поверхности металла и предотвращают попадание влаги и кислорода.
Еще одним эффективным способом защиты является использование антикоррозионных покрытий. Эти покрытия наносятся на поверхность металла с помощью различных методов, таких как гальваническое осаждение или термическое напыление. Антикоррозионные покрытия создают защитный барьер между металлом и окружающей средой.
Для защиты металла от коррозии также используются специальные антикоррозионные добавки. Они добавляются в состав металлического материала или применяются в виде покрытий. Антикоррозионные добавки обладают высокой химической стабильностью и активно участвуют в процессах, предотвращающих разрушение металла.
Необходимо отметить, что эффективность защиты от коррозии зависит от правильного подбора и применения методов, материалов и покрытий. Кроме того, регулярное обслуживание и проверка состояния защитных слоев также являются важными факторами для поддержания долговечности и надежности металлических конструкций.
Вопрос-ответ

Какие металлы подвержены коррозии?
Коррозии подвержены различные металлы, но наиболее чувствительны к коррозии железо, сталь, цинк, алюминий и медь. Это связано с их химическими свойствами и способностью образовывать оксидные пленки на поверхности, которые становятся причиной коррозии.
Какова схема химической реакции коррозии?
Схема химической реакции коррозии металлов выглядит следующим образом: металл + вода + кислород = оксид металла + вода. Например, для железа это будет следующая реакция: 4Fe + 3O2 + 6H2O = 4Fe(OH)3. В результате образуется соединение металла с кислородом, которое создает защитную пленку на поверхности металла, но со временем она разрушается и коррозия продолжается.
