Коррозия – это процесс, который является неотъемлемой частью жизненного цикла металлических материалов. Он приводит к разрушению металла под воздействием окружающей среды. Основным механизмом коррозии является окислительно-восстановительный процесс, который происходит на поверхности материала.
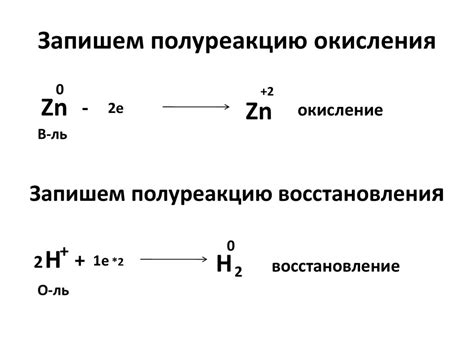
Окислительно-восстановительный процесс – это химическая реакция, в ходе которой происходит передача электронов от одного металла к другому или от металла к окружающей среде. В результате этой реакции происходит образование оксидов и восстановление исходного металла.
Коррозия металлов нарушает их структуру и свойства, что может привести к значительному ухудшению качества и прочности изделий из металла. Особенно подвержены коррозии такие металлы, как железо и его сплавы (сталь), алюминий, медь и их сплавы.
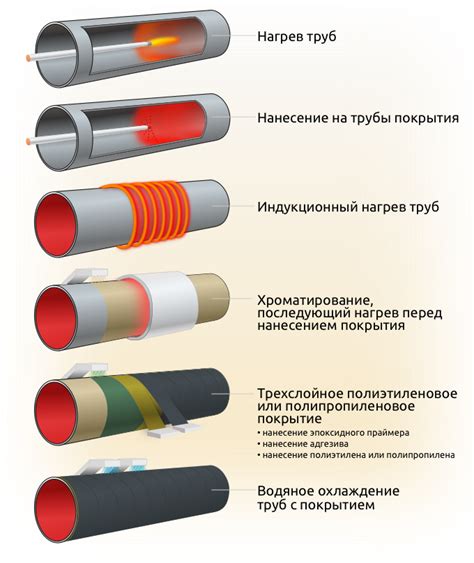
Для защиты металлов от коррозии существует несколько методов, включающих использование различных защитных покрытий, антикоррозийной обработки и правильного хранения и транспортировки металлопродукции. Эффективная борьба с коррозией – это важная задача для всех отраслей промышленности и науки.
Виды коррозии металлов и их причины

Коррозия металлов – это процесс разрушения металлических материалов, вызванный их взаимодействием с окружающей средой. Коррозия может приводить к значительному ухудшению качества и прочности металлических конструкций, а также приводить к потере их функциональности.
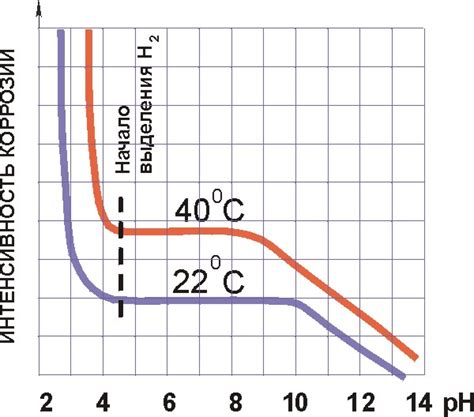
В зависимости от причин и условий, существуют различные виды коррозии металлов. Один из наиболее распространенных видов – электрохимическая коррозия. Она возникает в результате взаимодействия металла с влажным воздухом или жидкостью, когда металл выступает в роли анода, а окружающая среда – в роли катода. Это приводит к тому, что металл постепенно окисляется, а его поверхность покрывается ржавчиной или другими продуктами коррозии.
Еще одним распространенным видом коррозии является контактная коррозия. Она возникает при соприкосновении различных металлов в наличии электролита. Различные металлы имеют различный потенциал, что создает условия для электрохимических реакций и распада металлов. Например, при контакте алюминия и стали под воздействием влаги, происходит активная коррозия алюминия, а сталь остается неповрежденной.
Кроме того, существует пятая покровная коррозия, при которой на металлической поверхности образуется коррозионный слой. В результате этого, металл может быть защищен от дальнейшей коррозии. Примером этого явления может служить образование пассивной оксидной пленки на поверхности алюминия или стали, что защищает металл от дальнейшего окисления.
Атмосферная коррозия: влияние воздуха и влаги

Атмосферная коррозия является распространенным видом коррозии металлов, которая происходит под воздействием атмосферных условий. Основными факторами, влияющими на атмосферную коррозию, являются воздух и влага.
Кислород, содержащийся в воздухе, является одной из основных причин атмосферной коррозии. Когда металл вступает в контакт с кислородом, происходит окислительно-восстановительный процесс, в результате которого металл окисляется. Окисление металла приводит к образованию оксидов, которые часто являются нестабильными и могут отслаиваться, открывая новую поверхность металла для дальнейшей коррозии.
Влага также играет важную роль в атмосферной коррозии. Когда металл находится во влажной среде, вода может проникать в поры и трещины поверхности металла. Это создает условия для электрохимических реакций, которые способствуют коррозии. Вода содержит различные растворенные соли и кислоты, которые могут усилить атмосферную коррозию путем повышения электропроводности и активности агрессивных веществ.
Влияние атмосферной коррозии может быть усилено другими факторами, такими как загрязнение воздуха, промышленные выбросы и климатические условия. Однако, с помощью специальных защитных покрытий и регулярного технического обслуживания, можно снизить риск атмосферной коррозии и продлить срок службы металлических конструкций.
Электрохимическая коррозия: роль электрического тока

Электрохимическая коррозия — это процесс разрушения металлической поверхности под воздействием окружающей среды. Она вызывается электрохимическими реакциями, которые происходят на поверхности металла при наличии внешнего электрического тока.
Роль электрического тока в электрохимической коррозии заключается в том, что он активирует электрохимические процессы на поверхности металла. Когда металл находится в контакте с электролитом (вещество, способное проводить электрический ток), происходят окислительно-восстановительные реакции.
При наличии электрического тока происходит положительно-заряженные ионы металла переносятся на анод, где происходит окисление металла, и на катоде происходит восстановление других ионов. Это приводит к растворению и разрушению металла, что и является основным проявлением коррозии.
Избыток электрического тока может ускорить процесс коррозии, так как он усиливает электрохимические реакции на поверхности металла. Неконтролируемое погружение металла в электролит или неправильное подключение различных металлов в одной системе может вызывать интенсивное и быстрое разрушение металлической конструкции.
Для защиты от электрохимической коррозии необходимо контролировать токи, которые протекают на поверхности металла. Для этого применяют различные методы, такие как анодная и катодная защита, использование гальванических пар и покрытий из защитных материалов. Такие меры позволяют снизить или полностью предотвратить разрушение металлической поверхности под воздействием электрохимических реакций.
Гальваническая коррозия: взаимодействие различных металлов

Гальваническая коррозия является одним из основных механизмов разрушения металлических конструкций. Она происходит при контакте двух различных металлов в присутствии электролита, такого как вода или раствор солей. Взаимодействие различных металлов ведет к образованию гальванической пары, в результате чего один металл становится анодом, а другой - катодом.
В процессе гальванической коррозии анод, или более активный металл, теряет электроны и окисляется. Электроны переходят на катод, или менее активный металл, который при этом восстанавливается. Со временем анод начинает распадаться, образуя коррозионные продукты, в то время как катод остается относительно неповрежденным.
Взаимодействие различных металлов в гальванической паре может привести к ускоренной коррозии. Как правило, металл с более низким значением потенциала (более активный) будет служить анодом и подвергаться коррозии. Например, при соприкосновении железа и меди, медь будет играть роль катода, а железо - роль анода. В результате, железо будет подвергаться гальванической коррозии, особенно если электролит, такой как влажная среда или соли, присутствует.
Для предотвращения гальванической коррозии, необходимо принять определенные меры. Например, можно применить покрытия, которые электрохимически нейтрализуют разность потенциалов между металлами. Также можно использовать изоляцию или прокладывать разделительную прокладку между металлическими элементами.
Контактная коррозия: повреждение при соприкосновении с другими материалами

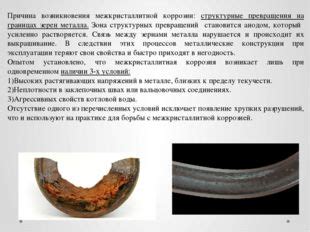
Контактная коррозия - это особый вид коррозии металлов, который возникает в результате соприкосновения металла с другими материалами, такими как металлы с разной электрохимической активностью или неметаллические материалы.
При контакте различных металлов может происходить гальваническая реакция, при которой более активный металл будет выступать в роли анода, а менее активный – в роли катода. В результате этой реакции, анодный металл начинает активно окисляться, а катодный металл становится зоной сниженной концентрации кислорода и может подвергаться растворению. Это приводит к повреждению и разрушению металла.
Помимо металло-металлического контакта, контактная коррозия может возникать при соприкосновении металла с другими материалами, такими как дерево, пластик или резина. Некоторые неметаллические материалы могут содержать в себе химические вещества, которые способствуют коррозии металла. Например, дерево может содержать кислые соединения, которые могут вызывать разрушение металла, особенно в условиях повышенной влажности.
Примером контактной коррозии может служить повреждение алюминиевой кровли, когда металл контактирует с железными креплениями или свинцовой мягкой плетенкой. В результате этого контакта происходит гальваническая реакция, которая приводит к образованию коррозионных участков на поверхности алюминия.
Для предотвращения контактной коррозии необходимо принимать меры, такие как использование изоляционных материалов для разделения контактных поверхностей металлов, применение антикоррозийного покрытия или использование специальных смазок и прокладок.
Высокотемпературная коррозия: воздействие высоких температур и агрессивных сред

Высокотемпературная коррозия является одним из важных аспектов при изучении процессов, связанных с разрушением металлических материалов. Агрессивные среды и высокая температура могут вызывать различные виды коррозии, которые имеют серьезное влияние на функциональность металлических изделий.
При воздействии высоких температур на металлы, происходит окисление и образование оксидных пленок на металлической поверхности. Это может привести к дополнительным процессам коррозии, таким как диффузия кислорода вглубь металла или образование металлических соединений с оксидами. Также высокие температуры способствуют активации химических реакций, увеличивают скорость разрушения металлов и структурных материалов.
Агрессивные среды, такие как газы, пары и жидкости, могут ускорить процессы коррозии при высоких температурах. Например, наличие водяного пара в окружающей атмосфере может вызвать образование водорода, который будет реагировать с металлом и вызывать коррозию, известную как водородная коррозия. Также агрессивные среды могут содержать кислоты, щелочи или другие химически активные вещества, которые будут воздействовать на металл и приводить к его разрушению.
Для защиты металлических изделий от высокотемпературной коррозии применяются различные методы, включая использование специальных защитных покрытий, легирование металлов специальными элементами, подбор противокоррозионных материалов и конструктивных решений. Также важным фактором является контроль температуры и химического состава среды, находящейся в контакте с металлом, чтобы минимизировать риск возникновения высокотемпературной коррозии.
Вопрос-ответ

Что такое коррозия металлов?
Коррозия металлов - это процесс разрушения металлов в результате их взаимодействия с окружающей средой, в частности с водой или влагой. Это особенно актуально для железных и стальных изделий, которые подвергаются ржавлению.
Как происходит окислительно-восстановительный процесс при коррозии металлов?
Окислительно-восстановительный процесс при коррозии металлов происходит в результате реакции металла с окислителем. Металл, попадая в контакт с влагой и кислородом, окисляется, а окислитель (кислород, вода или другие вещества) восстанавливается. Эта реакция приводит к образованию оксидов металла, которые являются основной причиной разрушения материала.
Какие условия способствуют развитию коррозии металлов?
Развитию коррозии металлов способствуют влажная среда, наличие кислорода и наличие электролита (вещества, способного проводить электрический ток, например, соли или кислоты). Также важными факторами являются температура и наличие механических повреждений на поверхности металла, которые могут ускорить процесс коррозии.